Orale Probiotika bekämpfen Zahnfleischerkrankungen
 In Zeiten der COVID-19-Pandemie scheint die Pflege der Mundhygiene besonders wichtig zu sein. Der menschliche Mund ist voller Bakterien, die Zahnhöhlen und schwerwiegendere Gingivitis und Parodontitis verursachen können. Selbst gute Mundhygienegewohnheiten, zweimal täglich zu bürsten und Zahnseide zu verwenden, reichen möglicherweise nicht aus, um sie abzuwehren.
In Zeiten der COVID-19-Pandemie scheint die Pflege der Mundhygiene besonders wichtig zu sein. Der menschliche Mund ist voller Bakterien, die Zahnhöhlen und schwerwiegendere Gingivitis und Parodontitis verursachen können. Selbst gute Mundhygienegewohnheiten, zweimal täglich zu bürsten und Zahnseide zu verwenden, reichen möglicherweise nicht aus, um sie abzuwehren.
Fast ein Drittel der Erwachsenen in den USA leidet an unbehandelter Karies, und fast die Hälfte der über 30-Jährigen leidet an Parodontitis (Zahnfleischerkrankungen ).1,2
Zahnfleischerkrankungen können schwerwiegend sein. Im weiteren Verlauf kann es zu Zahnverlust sowie zu Entzündungen kommen, die degenerative Alterungsprozesse beschleunigen.3 Zahnfleischerkrankungen können zu Herzproblemen, Krebs, Alzheimer, Lungen- und Nierenerkrankungen und mehr führen.4-14
Wissenschaftler, die nach einer Lösung für Zahnfleischerkrankungen und Karies suchen, haben einen innovativen Weg gefunden, um das Risiko durch gezielte orale probiotische Lutschtabletten zu verringern.
Das orale Mikrobiom
Die natürliche Gemeinschaft der im Mund lebenden Mikroben wird als orales Mikrobiom bezeichnet. Ein gesundes Mikrobiom unterstützt und schützt die empfindlichen Schleimhäute sowie die Oberfläche der Zähne.
Wenn diese Gemeinschaft gestört und aus dem Gleichgewicht gerät - sei es durch schlechte Ernährung, Lebensstil, Drogen oder Krankheit -, führt dies zu einem mikrobiellen Ungleichgewicht (Dysbiose genannt), das die normale Reaktion des Immunsystems in Mitleidenschaft zieht.
Dysbiose führt zu zahlreichen Problemen im Mund, einschließlich Hohlräumen, die durch übermäßig säureproduzierende Bakterien entstehen, und Zahnfleischerkrankungen, die zum Zahnverlust beitragen, sowie zu entzündlichen Erkrankungen im gesamten Körper.
Die Notwendigkeit, ein gesundes orales Mikrobiom wiederherzustellen, führte dazu, dass Wissenschaftler zwei Stämme guter Bakterien identifizierten, die Zahnfleischerkrankungen an zwei Fronten bekämpfen können. Der erste, L. plantarum L-137, stärkt die orale Immunfunktion und fördert die Heilung. Der zweite, S. salivarius M18, tötet schädliche Bakterien ab, die im Mund leben, und lässt sich gedeihen.15-17
Dieser zweigleisige Ansatz zur Vorbeugung von Zahnfleischerkrankungen unterstützt ein gesundes, ausgewogenes Mikrobiom im Mund, das Krankheiten aktiv widersteht und gleichzeitig die Heilung fördert.
Nutzung natürlicher Immunantworten
 Eines der Hauptprobleme bei einem unausgeglichenen oralen Mikrobiom besteht darin, dass es die natürlichen Fähigkeiten des Mundes zur Bekämpfung des Immunsystems verringert. Dies macht uns anfällig für Infektionen durch Bakterien, die Zahnfleischerkrankungen verursachen, wie Porphyromonas gingivalis.
Eines der Hauptprobleme bei einem unausgeglichenen oralen Mikrobiom besteht darin, dass es die natürlichen Fähigkeiten des Mundes zur Bekämpfung des Immunsystems verringert. Dies macht uns anfällig für Infektionen durch Bakterien, die Zahnfleischerkrankungen verursachen, wie Porphyromonas gingivalis.
P. gingivalis schwächt das Immunsystem des Mundes noch weiter, indem es das schützende IL-12 herunterreguliert und das entzündungsfördernde IL-6 hochreguliert, wodurch ein Teufelskreis entsteht, der es dem Körper nahezu unmöglich macht, sich selbst zu heilen.18-20
Um diesem krankheitsfördernden Zyklus entgegenzuwirken, suchten Wissenschaftler nach einer Möglichkeit, die lokale Immunfunktion zu stärken. Sie fanden ihre Antwort im harmlosen Bakterium Lactobacillus plantarum, Stamm L-137.17. Bei Abtötung durch Wärmebehandlung wurde festgestellt, dass dieser Stamm von L. plantarum die Produktion des schützenden IL-12 erhöht.
Die Behandlung von Parodontitis-Patienten mit diesem immunverstärkenden Bakterium hilft, die durch P. gingivalis verursachte Beeinträchtigung der Immunfunktion im Mund zu überwinden. Dies hilft bei der Wiederherstellung der natürlichen oralen Immunantwort des Körpers, was wiederum die Heilung des erkrankten, entzündeten Zahnfleisches fördert.
Mit anderen Worten, L. plantarum verstopft im Wesentlichen das durch ausweichendes P. gingivalis und andere Bakterien induzierte „Loch“ des Immunsystems und ermöglicht unserem Körper, Zahnfleischerkrankungen auf natürliche Weise zu widerstehen.17
Die Auswirkungen wurden in einer klinischen Studie an Menschen mit chronischer Parodontitis beobachtet.
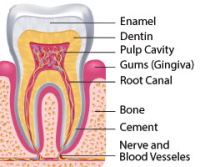 Zahn- und Zahnfleischerkrankungen werden oft übersehen und tragen mit zunehmendem Alter zu einer schlechten Gesundheit bei.
Zahn- und Zahnfleischerkrankungen werden oft übersehen und tragen mit zunehmendem Alter zu einer schlechten Gesundheit bei.- Diese Zustände beeinträchtigen nicht nur die Funktionen des Mundes, sondern prädisponieren uns auch für Herz-, Lungen-, Gehirn-, Leber- und andere altersbedingte Störungen.
- Ein ausgewogenes orales Mikrobiom hilft dabei, einen Zustand der Krankheitsresistenz aufrechtzuerhalten.
- Ein unausgeglichenes oder dysbiotisches Mikrobiom führt zu einer Katastrophe, indem es die ausgefeilte natürliche Immun- und Bakterienabwehr gegen orale Erkrankungen verändert.
- Das Ausbalancieren eines dysbiotischen oralen Mikrobioms kann die natürliche Krankheitsresistenz wiederherstellen.
- HT-L. plantarum L-137 ist ein wärmebehandelter Stamm üblicher Lactobacillus-Bakterien, der in der Lage ist, im Mund heilende Zytokine zu induzieren und die lokale Immunität zu stärken.
- S. salivarius M18 ist ein lebender probiotischer Stamm, der mit starken Lantibiotika ausgestattet ist, die schädliche Bakterien abtöten.
- Das Hinzufügen dieser gesunden Bakterien zu einer regelmäßigen Routine des Bürstens und Zahnseidens kann dazu beitragen, den Mund zu einem sicheren Ort für schützende Mikroben zu machen, was Vorteile für den gesamten Körper bringt.
Klinische Studie
Die Forscher führten eine randomisierte Studie durch, an der 39 Personen mit chronischer Parodontitis teilnahmen.17 Die Probanden erhielten nach dem Zufallsprinzip 12 Wochen lang entweder ein Placebo oder das L. plantarum L-137-Präparat.
Innerhalb von 12 Wochen haben die Forscher die Tiefe der Sondiertasche gemessen, dh den Abstand zwischen dem Zahnfleischrand und dem Boden der winzigen „Tasche“ zwischen Zahnfleisch und Zahnwurzel.17 Eine normale, gesunde Zahnfleischtasche ist 3 mm tief oder weniger und eine Tiefe von 4 mm oder mehr definiert Parodontitis.21 Tiefere Taschen sind ein klinisches Maß für Parodontitis.
Nach 12 Wochen zeigten Probanden, die mit L. plantarum L-137 ergänzt wurden, eine um 64% größere Verbesserung der Taschentiefe im Vergleich zu Placebo-Empfängern.17
Diese bemerkenswerte Studie zeigte, dass es möglich ist, Parodontitis durch Modulation des oralen Immunsystems zu verbessern.
Die Verbesserung der Taschentiefe ist ein Teil des Puzzles. Ebenso wichtig ist es, das Gleichgewicht in der mikrobiellen Gemeinschaft des Mundes wiederherzustellen. Auf diese Weise können wir eine Immunschwäche und die daraus resultierenden entzündlichen Veränderungen verhindern, bevor sie einsetzen. Hier hilft ein orales Probiotikum namens S. salivarius M18.
 Parodontitis (Zahnfleischerkrankungen) kann schmerzhaft, entstellend und sogar behindernd sein, wenn Zahnverlust und Kieferknochenresorption auftreten.
Parodontitis (Zahnfleischerkrankungen) kann schmerzhaft, entstellend und sogar behindernd sein, wenn Zahnverlust und Kieferknochenresorption auftreten.
Neue wissenschaftliche Erkenntnisse zeigen jedoch, dass Parodontitis weitreichende Folgen hat, die sich auf die meisten Körpersysteme erstrecken und hauptsächlich auf entzündliche Veränderungen und andere Störungen des Signalwegs im gesamten Körper zurückzuführen sind.
Zahnfleischerkrankungen sind jetzt mit Störungen des Gehirns, des Herzens, der Lunge, der Niere, der Leber und der Blutgefäße verbunden, die alle das Altern fördern und die Lebensdauer verkürzen.7-14
Die gute Nachricht ist, dass die Reduzierung von mit Bakterien beladenem Plaque zu einer signifikanten Verringerung der Entzündung des gesamten Körpers führt.29 Dies bedeutet, dass die Verbesserung unserer Zahn- und Zahnfleischgesundheit nicht nur für diese Mundstrukturen von entscheidender Bedeutung ist, sondern auch für die Erhaltung unserer Gesundheit in praktisch allen Körpersystemen .
Ein gut bewaffnetes probiotisches Mundverteidigungssystem
 Ein krankheitsresistentes orales Mikrobiom enthält eine Vielzahl von Mikroben, die wichtige biologische Funktionen erfüllen. Ein dysbiotisches Mikrobiom ist eines, in dem ein oder mehrere schädliche Stämme dominieren, andere nützliche Organismen unterdrücken und eine krankheitszulässige Umgebung schaffen.
Ein krankheitsresistentes orales Mikrobiom enthält eine Vielzahl von Mikroben, die wichtige biologische Funktionen erfüllen. Ein dysbiotisches Mikrobiom ist eines, in dem ein oder mehrere schädliche Stämme dominieren, andere nützliche Organismen unterdrücken und eine krankheitszulässige Umgebung schaffen.
Die Forschung beweist, dass es zur Wiederherstellung der Mundgesundheit und zur Vermeidung von Problemen wie Zahnfleischerkrankungen notwendig ist, die Besiedlung und das Wachstum von Nützlingen zu unterstützen.22
Die hilfreichen Organismen konkurrieren mit den „Bösen“, indem sie ihre Populationen verkleinern und einem breiteren Spektrum nützlicher Mikroben den Erfolg ermöglichen.
S. salivarius M18 ist einer der „Guten“. Es konkurriert mit gefährlichen oralen Bakterien, die Parodontitis verursachen oder verschlimmern, und es wurde gezeigt, dass es die Parameter von Gingivitis und Parodontitis verbessert.15,16
Eine randomisierte, kontrollierte Studie wurde durchgeführt, um den Einfluss der Behandlung mit S. salivarius M18 auf einige der wichtigsten klinischen Parameter der Mund- und Zahnfleischgesundheit zu bestimmen.23 Die Studie umfasste Männer und Frauen im Alter von 20 bis 60 Jahren mit mittelschweren oder schweren Erkrankungen Gingivitis (Gingivaindex-Score von 2 oder 3) und mäßige Parodontitis (weniger als 6 mm Sondiertaschentiefe).
Die Hälfte der Probanden erhielt keine Behandlung und die Hälfte erhielt nach dem Bürsten täglich Lutschtabletten mit 200 Millionen S. salivarius M18. Die Probanden nahmen die Lutschtabletten 30 Tage lang ein, und die Forscher beobachteten sie weitere 30 Tage lang, um festzustellen, ob der Nutzen auch dann bestehen bleiben würde, wenn die Probanden die Einnahme des Probiotikums abbrachen.
Die Ergebnisse der S. salivarius M18-Gruppe waren für alle vier Messungen im Vergleich zur Kontrollgruppe günstig: 23
- Der mittlere Plaque-Index-Score wurde am 30. Tag (dem letzten Behandlungstag) um 44% und am 60. Tag um 37% reduziert.
- Der mittlere Gingivalindex wurde am 30. Tag um 42% und am 60. Tag um 35% reduziert.
- Die modifizierten Sulcusblutungsindexwerte wurden am 30. Tag um 53% und am 60. Tag um 51% reduziert.
- Schließlich wurden die Messungen der Sondiertaschentiefe am 30. Tag um 20% und am 60. Tag um 22% reduziert.
Bemerkenswerterweise zeigten die niedrigsten Werte für jeden Index in der S. salivarius M18-Gruppe eine Rückkehr zu nahezu normalen Werten von weniger als 1 für Plaqueindex, Gingivaindex und modifizierten Sulkusblutungsindex und eine Sondierungstaschentiefe von etwas mehr als 3 mm. Diese Werte blieben bei Kontrollpersonen deutlich abnormal.23
Diese Studie zeigte die Fähigkeit der probiotischen Raute, nicht nur alle vier wichtigsten Parameter der parodontalen Gesundheit signifikant zu verbessern, sondern auch lange nach Beendigung der Supplementierung weiterzuarbeiten.
Frühere klinische Studien unterstützen die Verwendung von S. salivarius M18 für die Mundgesundheit zusätzlich. In einem Fall hielten 88% der Empfänger von S. salivarius M18 die Plaque-Scores am Ende eines dreimonatigen Behandlungszeitraums niedriger als ihre Ausgangswerte vor der Behandlung, verglichen mit nur 44% der Placebo-Empfänger.15
 Dysbiose (ein unausgeglichenes Mikrobiom) im Mund führt zu einer tiefgreifenden Funktionsstörung des Immunsystems, die zum Schutz von Zähnen und Zahnfleisch entwickelt wurde und zwei wesentliche Auswirkungen auf die Mundgesundheit hat:
Dysbiose (ein unausgeglichenes Mikrobiom) im Mund führt zu einer tiefgreifenden Funktionsstörung des Immunsystems, die zum Schutz von Zähnen und Zahnfleisch entwickelt wurde und zwei wesentliche Auswirkungen auf die Mundgesundheit hat:
- Erstens sind orale Dysbiose und pathogene Bakterien (z. B. P. gingivalis) mit einer erhöhten Aktivität von entzündlichen Zytokinen (Signalmolekülen), insbesondere IL-6.18, verbunden
- Zweitens reduziert Dysbiose die Produktion von IL-12, einem regulatorischen Zytokin, das gesunde Immunantworten und die Heilung nach Entzündungen unterstützt. Diese veränderte Immunantwort trägt zu einer anhaltenden Entzündung und einer verlangsamten Heilung bei, eine Situation, die die zerstörerischen Mikroben ausnutzen können, um ihr eigenes Wachstum zu fördern.18,30,31
Die IL-12-Produktion nimmt mit zunehmendem Alter ab und hinterlässt ein „Loch“ in den Immunantworten im Mund.32 Dadurch können Organismen wie P. gingivalis dem Immunsystem ausweichen und überwachsen, was letztendlich zu Zahnfleischerkrankungen führt.30
Erschwerend kommt hinzu, dass P. gingivalis selbst auch die Immunantwort des Wirts beeinträchtigt, insbesondere das nützliche IL-12 reduziert und das proinflammatorische IL-6.18-20,30 hochreguliert. Dies ermöglicht das Überwachsen von P. gingivalis und anderen infektions- und entzündungserzeugenden Mikroben.33
Wenn die IL-6-Spiegel hoch und die IL-12-Spiegel niedrig bleiben, ist es außerdem nahezu unmöglich, dass sich eine Zahnfleischentzündung von selbst auflöst. Dies führt zu einem chronischen Entzündungszustand, der schließlich die knöcherne Zahnpfanne erodiert und letztendlich zu Zahnverlust führt.10,18-20
In einem eleganten, aber zerstörerischen Prozess setzt P. gingivalis chemische Fragmente frei, die die Wirkung bestimmter Immunzellen unterdrücken, sich als normaler, nützlicher Organismus „verkleiden“ und gleichzeitig in das Gewebe des Wirts eindringen und dessen Immunantwort auch gegenüber anderen Bakterienarten unterdrücken.
Wie es funktioniert
 S. salivarius M18 wirkt durch verschiedene Maßnahmen, um eine gesündere Mundumgebung zu schaffen. Im Gegensatz zu vielen probiotischen Formulierungen kann S. salivarius M18 spezifisch den menschlichen Mund besiedeln. Dies führt zu stabilen, reproduzierenden Kolonien dieses nützlichen Organismus, selbst nachdem die Supplementierung beendet ist.16
S. salivarius M18 wirkt durch verschiedene Maßnahmen, um eine gesündere Mundumgebung zu schaffen. Im Gegensatz zu vielen probiotischen Formulierungen kann S. salivarius M18 spezifisch den menschlichen Mund besiedeln. Dies führt zu stabilen, reproduzierenden Kolonien dieses nützlichen Organismus, selbst nachdem die Supplementierung beendet ist.16
Es wurde auch gezeigt, dass S. salivarius M18 effektiv mit Bakterien (wie Streptococcus mutans) konkurriert, die Hohlräume verursachen und gesunde Zähne und Zahnfleisch unterstützen können.15
S. salivarius M18 ist ein reichlich vorhandener Hersteller von bakterienunterdrückenden Waffen, die als Bakteriozine bezeichnet werden.
Bakteriozine wirken ähnlich wie Antibiotika, sind jedoch völlig natürlich und scheinen nur auf lokaler Ebene zwischen verschiedenen Bakterienstämmen zu wirken.24
Die spezifischen Bakteriozine, die S. salivarius M18 produziert, gehören zu einer Klasse namens Lantibiotika, die eine Wirkungsweise verwenden, die buchstäblich ein Loch oder eine Pore in der Zellmembran des Zielorganismus erzeugt, die zu dessen Zerstörung führt.25,26 Auf diese Weise kann S. Es wurde gezeigt, dass Salivarius M18 das Wachstum mehrerer bekannter Organismen, die Zahn- und Zahnfleischerkrankungen produzieren, hemmt, einschließlich S. mutans, S. sobrinus und Actinomyces naeslundii.15,24,27,28
S. salivarius M18 zielt nicht nur auf krankheitsverursachende Organismen ab, sondern produziert auch Enzyme, die zum Abbau von Zahnbelag beitragen, der eine Hauptursache für Karies und Zahnfleischerkrankungen darstellt. S. salivarius M18 hilft auch dabei, einen neutralen pH-Wert im Mund zu erzeugen, der gesunde Bakterien unterstützt, das orale Mikrobiom weiter ausgleicht und das Krankheitsrisiko verringert.15
Ein weiteres Forschungsergebnis ist, dass S. salivarius M18 das Vorhandensein des proinflammatorischen Zytokins IL-6 reduziert, das mit Parodontitis assoziiert ist.15 Dies ergänzt eine vorteilhafte Überlappung mit den immunmodulierenden Merkmalen von L. plantarum L-137 Zusätzlicher Schutz gegen chronische Zahnfleischentzündungen.
 All das Stöbern und Stöbern in Ihrem Mund beim Zahnarzt macht keinen Spaß. Aber der Zahnarzt oder Hygieniker untersucht tatsächlich sorgfältig mehrere Merkmale von Zähnen und Zahnfleisch.
All das Stöbern und Stöbern in Ihrem Mund beim Zahnarzt macht keinen Spaß. Aber der Zahnarzt oder Hygieniker untersucht tatsächlich sorgfältig mehrere Merkmale von Zähnen und Zahnfleisch.
Diese wurden in mehrere Scores standardisiert, die zur Messung der Zahnfleischgesundheit sowie zur Bestimmung der besten Behandlungsoption nützlich sind.
In den in diesem Artikel zitierten Studien werden folgende verwendet:
- Der Plaque-Index-Score: eine Bewertung von 0 bis 3, wobei Null keine Plaque ist und 3 eine Fülle von Plaque ist, die sich unterhalb des Zahnfleischs an den Zähnen erstreckt.34
- Der Gingival Index Score: eine Bewertung von 0 bis 3, wobei Null normales Zahnfleisch ist und 3 eine schwere Entzündung mit Schwellung, Geschwüren und einer Tendenz zu spontanen Blutungen anzeigt.34
- Der modifizierte Sulcus-Blutungsindex-Score: eine Bewertung von 0 bis 3, wobei Null keine Blutung mit sanfter Zahnuntersuchung und 3 Blutungen, Farbveränderungen und Zahnfleischschwellungen sind.35
- Sondiertaschentiefe: Mit einer in Millimetern markierten kalibrierten Sonde misst der Zahnarzt oder Hygieniker die Tiefe der Tasche zwischen Zahnwurzel und Zahnfleisch. Im Allgemeinen ist die Zahnfleischerkrankung umso schlimmer, je tiefer die Tasche ist. Taschen mit einer Tiefe von 3 mm oder weniger gelten als normal, während Taschen mit einer Tiefe von weniger als 4 mm auf Parodontitis hinweisen.21,36
Zusammenfassung
Zahnfleischerkrankungen sind weit verbreitet, besonders wenn wir älter als 30 Jahre sind.
Zahnbürsten und Zahnseide sind wichtig, reichen jedoch nicht aus, um ein beschädigtes orales Mikrobiom wieder in seinen natürlichen, krankheitsresistenten Zustand zu versetzen.
Jüngste Fortschritte beim Verständnis nützlicher Bakterien (Probiotika) zeigen einen zweigleisigen Ansatz zur Wiederherstellung eines ausgeglichenen Mikrobioms und zur Verjüngung einer gesunden Immunfunktion im Mund.
L. plantarum L-137 ist ein wärmebehandeltes Präparat aus nützlichen L. plantarum-Bakterien, das die orale Immunfunktion stärkt, Entzündungen reduziert und die Heilung fördert.
S. salivarius M18 ist ein bewährtes orales Probiotikum, das den menschlichen Mund besiedeln und dort schädliche Bakterien abtöten kann.
Wenn diese beiden Probiotika als tägliche Lutschtablette eingenommen werden, können sie zusammenwirken, um nicht nur die Mund-, sondern auch die Ganzkörpergesundheit zu verbessern.
Material mit Genehmigung von Life Extension verwendet. Alle Rechte vorbehalten.
-
Available at: http://www.cdc.gov/OralHealth/children_adults/adults.htm. Accessed October 25, 2016.
-
Available at: http://www.cdc.gov/oralhealth/periodontal_disease/. Accessed December 8, 2016.
-
Sampaio-Maia B, Caldas IM, Pereira ML, et al. The Oral Microbiome in Health and Its Implication in Oral and Systemic Diseases. Adv Appl Microbiol. 2016;97:171-210.
-
Saffi MA, Furtado MV, Polanczyk CA, et al. Relationship between vascular endothelium and periodontal disease in atherosclerotic lesions: Review article. World J Cardiol. 2015;7(1):26-30.
-
Yao QW, Zhou DS, Peng HJ, et al. Association of periodontal disease with oral cancer: a meta-analysis. Tumour Biol. 2014;35(7):7073-7.
-
Watts A, Crimmins EM, Gatz M. Inflammation as a potential mediator for the association between periodontal disease and Alzheimer’s disease. Neuropsychiatr Dis Treat. 2008;4(5):865-76.
-
Kamer AR, Pirraglia E, Tsui W, et al. Periodontal disease associates with higher brain amyloid load in normal elderly. Neurobiol Aging. 2015;36(2):627-33.
-
Prasanna SJ. Causal relationship between periodontitis and chronic obstructive pulmonary disease. J Indian Soc Periodontol. 2011;15(4):359-65.
-
Fisher MA, Taylor GW, West BT, et al. Bidirectional relationship between chronic kidney and periodontal disease: a study using structural equation modeling. Kidney Int. 2011;79(3):347-55.
-
Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 2015;15(1):30-44.
-
Humphrey LL, Fu R, Buckley DI, et al. Periodontal disease and coronary heart disease incidence: a systematic review and meta-analysis. J Gen Intern Med. 2008;23(12):2079-86.
-
Liu Z, Zhang W, Zhang J, et al. Oral hygiene, periodontal health and chronic obstructive pulmonary disease exacerbations. J Clin Periodontol. 2012;39(1):45-52.
-
Scannapieco FA, Bush RB, Paju S. Associations between periodontal disease and risk for nosocomial bacterial pneumonia and chronic obstructive pulmonary disease. A systematic review. Ann Periodontol. 2003;8(1):54-69.
-
Kshirsagar AV, Moss KL, Elter JR, et al. Periodontal disease is associated with renal insufficiency in the Atherosclerosis Risk In Communities (ARIC) study. Am J Kidney Dis. 2005;45(4):650-7.
-
Burton JP, Drummond BK, Chilcott CN, et al. Influence of the probiotic Streptococcus salivarius strain M18 on indices of dental health in children: a randomized double-blind, placebo-controlled trial. J Med Microbiol. 2013;62(Pt 6):875-84.
-
Burton JP, Wescombe PA, Macklaim JM, et al. Persistence of the oral probiotic Streptococcus salivarius M18 is dose dependent and megaplasmid transfer can augment their bacteriocin production and adhesion characteristics. PLoS One. 2013;8(6):e65991.
-
Iwasaki K, Maeda K, Hidaka K, et al. Daily Intake of Heat-killed Lactobacillus plantarum L-137 Decreases the Probing Depth in Patients Undergoing Supportive Periodontal Therapy. Oral Health Prev Dent. 2016;14(3):207-14.
-
Liang S, Krauss JL, Domon H, et al. The C5a receptor impairs IL-12-dependent clearance of Porphyromonas gingivalis and is required for induction of periodontal bone loss. J Immunol. 2011;186(2):869-77.
-
Johnson RB, Serio FG. Interleukin-18 concentrations and the pathogenesis of periodontal disease. J Periodontol. 2005;76(5):785-90.
-
Gemmell E, Seymour GJ. Immunoregulatory control of Th1/Th2 cytokine profiles in periodontal disease. Periodontol 2000. 2004;35:21-41.
-
Available at: http://www.merckmanuals.com/professional/dental-disorders/periodontal-disorders/periodontitis. Accessed February 1, 2017.
-
Bonifait L, Chandad F, Grenier D. Probiotics for oral health: myth or reality? J Can Dent Assoc. 2009;75(8):585-90.
-
Scariya L, Nagarathna DV, Varghese M. Probiotics in Periodontal Therapy. Int J Pharm Bio. 2015 Jan;6(1):242-50.
-
Wescombe PA, Upton M, Renault P, et al. Salivaricin 9, a new lantibiotic produced by Streptococcus salivarius. Microbiology. 2011;157(Pt 5):1290-9.
-
Bierbaum G, Sahl HG. Lantibiotics: mode of action, biosynthesis and bioengineering. Curr Pharm Biotechnol. 2009;10(1):2-18.
-
Islam MR, Nagao J, Zendo T, et al. Antimicrobial mechanism of lantibiotics. Biochem Soc Trans. 2012;40(6):1528-33.
-
Wescombe PA, Burton JP, Cadieux PA, et al. Megaplasmids encode differing combinations of lantibiotics in Streptococcus salivarius. Antonie Van Leeuwenhoek. 2006;90(3):269-80.
-
Wescombe PA, Upton M, Dierksen KP, et al. Production of the lantibiotic salivaricin A and its variants by oral streptococci and use of a specific induction assay to detect their presence in human saliva. Appl Environ Microbiol. 2006;72(2):1459-66.
-
Fasula K, Evans CA, Boyd L, et al. Randomized trial of Plaque identifying Toothpaste: Dental Plaque and Inflammation. Am J Med. 2016.
-
Hajishengallis G, Shakhatreh MA, Wang M, et al. Complement receptor 3 blockade promotes IL-12-mediated clearance of Porphyromonas gingivalis and negates its virulence in vivo. J Immunol. 2007;179(4):2359-67.
-
Li L, Hsu HC, Stockard CR, et al. IL-12 inhibits thymic involution by enhancing IL-7- and IL-2-induced thymocyte proliferation. J Immunol. 2004;172(5):2909-16.
-
Banerjee C, Ulloor J, Dillon EL, et al. Identification of serum biomarkers for aging and anabolic response. Immun Ageing. 2011;8(1):5.
-
Costalonga M, Herzberg MC. The oral microbiome and the immunobiology of periodontal disease and caries. Immunol Lett. 2014;162(2 Pt A):22-38.


