Elimine libras al inhibir el almacenamiento de grasa celular
 Las autoridades sanitarias advierten sobre las consecuencias devastadoras de la obesidad, pero los médicos no saben qué hace que las personas acumulen tantos kilos de grasa a medida que envejecen.
Las autoridades sanitarias advierten sobre las consecuencias devastadoras de la obesidad, pero los médicos no saben qué hace que las personas acumulen tantos kilos de grasa a medida que envejecen.
A través de una serie de estudios bien diseñados, los científicos que investigaron ciertos extractos de plantas descubrieron que pueden bloquear el almacenamiento de grasa a nivel celular.
En un avance científico significativo, se ha identificado una nueva y potente arma para ayudar a inducir la pérdida de peso de manera segura.
Este artículo describe cómo un nuevo extracto de planta dual modula favorablemente seis vías que utilizan las células grasas para desencadenar el aumento de peso.
Cuando se probó en humanos en un estudio controlado con placebo, aquellos que tomaron este extracto de planta dual perdieron 4.05 pulgadas de grasa abdominal y bajaron 11.4 libras después de ocho semanas... con una pérdida de peso observada a los 14 días.1
Las células que almacenan grasa se llaman adipocitos. Se depositan en todo nuestro cuerpo.2,3
A medida que envejecemos, los adipocitos tienden a expandirse y congregarse en áreas cosméticamente antiestéticas y perjudiciales para nuestra salud.
De mayor preocupación son los adipocitos que se depositan en lo profundo de nuestro abdomen. Esta “grasa visceral” representa más que la grasa almacenada en nuestra cintura. La grasa visceral es un tejido químicamente activo que produce un torrente de citocinas proinflamatorias.4
Las personas con grasa abdominal abultada sufren un bombardeo constante de citoquinas tóxicas que desencadenan el síndrome metabólico y sus consecuencias mortales.5,6
Este problema generalizado llevó a los científicos a buscar extractos de plantas que interfirieran específicamente con el almacenamiento de grasa de los adipocitos en nuestra anatomía abdominal.
Cómo se produce el almacenamiento de grasa no deseado
El exceso de calorías se transforma en depósitos de grasa en los adipocitos7 a través de un proceso de varios pasos conocido como adipogénesis.
Cuando se consumen menos calorías, los adipocitos liberan grasa para cubrir las necesidades energéticas del organismo.8,9 Esto se conoce como lipólisis.
Se ha estudiado un extracto de planta dual basado en su capacidad para inhibir simultáneamente la adipogénesis (almacenamiento de grasa) y mejorar la lipólisis (descomposición y liberación de grasa).
Como cualquier otra célula, los adipocitos se desarrollan a partir de células madre indiferenciadas. Las células grasas prematuras en desarrollo se denominan preadipocitos. Cuando ingieres más calorías de las que tu cuerpo necesita, los preadipocitos “jóvenes” responden madurando a adipocitos “adultos”.7,10-12
Los adipocitos "adultos" absorben el exceso de ácidos grasos del torrente sanguíneo y comienzan a expandirse. Es este proceso de captación de ácidos grasos y expansión de adipocitos lo que finalmente da como resultado la obesidad y sus consecuencias patológicas. Cada exceso de calorías contribuye a la maduración y el crecimiento de las células grasas de esta manera. Más allá de cierto punto, los adipocitos se distienden y se hinchan, de la misma manera que lo hace tu barriga.
No todos los adipocitos son iguales. Mientras que las células grasas se distribuyen por todo el cuerpo, las que se almacenan en el abdomen (la llamada grasa visceral o grasa abdominal) son más que simples "recipientes" de almacenamiento.
Las células grasas del vientre son químicamente activas. Forman tejido graso capaz de liberar citoquinas proinflamatorias perjudiciales.4
En individuos obesos, la masa de exceso de depósitos de grasa visceral genera una avalancha proinflamatoria de citocinas. Esta liberación de citocinas provoca una cascada de efectos nocivos que, si no se controlan, contribuyen a la aparición de múltiples enfermedades degenerativas.5,6
Por lo tanto, el almacenamiento de grasa corporal no deseado ocurre cuando las células madre de preadipocitos maduran para almacenar el exceso de grasa en la dieta (adipogénesis), mientras que la capacidad para descomponer la grasa almacenada (lipólisis) disminuye.
 Una epidemia de obesidad continúa causando estragos en este país, con más de dos tercios de la población estadounidense con sobrepeso u obesidad.
Una epidemia de obesidad continúa causando estragos en este país, con más de dos tercios de la población estadounidense con sobrepeso u obesidad.- La medicina convencional aún tiene que ofrecer una solución práctica, segura y a largo plazo.
- Investigadores de vanguardia continúan identificando nuevos agentes naturales que inducen la pérdida de peso.
- Entre los más recientes se encuentra un extracto de planta dual que contiene extractos de la flor S. indicus y la fruta del mangostán, ambos nativos de Asia.
- Cuando se combinaron, se descubrió que la combinación de extractos duales resultante influía favorablemente en seis vías biomoleculares distintas mediante las cuales las células grasas desencadenan el aumento de peso. En ensayos clínicos controlados con placebo que involucraron sujetos obesos, este extracto dual indujo de manera segura una pérdida de peso total de 11.4 libras, una disminución de 2.05 en el índice de masa corporal (IMC) y una reducción de 4.05 pulgadas en la grasa visceral dañina después de solo ocho semanas.1
Combatir el almacenamiento de grasa corporal excedente
En busca de intervenciones naturales que inhiban eficazmente la acumulación de grasa (adipogénesis) y mejoren la quema de grasa (lipólisis), los científicos evaluaron más de mil plantas en busca de pruebas que cumplieran con este criterio.13
Dos plantas cuyos extractos demostraron efectos biológicos significativos fueron:
- Flor de Sphaeranthus indicus (S. indicus)13
- Fruta del mangostán (Garcinia mangostana).13
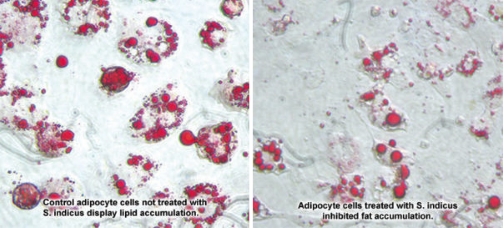
En el laboratorio, los extractos de S. indicus y mangostán impedían poderosamente la adipogénesis.
Cuando las células se trataron solo con S. indicus, el almacenamiento de grasa se inhibió hasta en un 65 %, en comparación con las células de control. Las fotografías (abajo) muestran una diferencia marcadamente visible entre los dos grupos de células. Las células de control muestran una apariencia hinchada y “espumosa”, llenas de gotitas de grasa, en comparación con las células más pequeñas y de contorno más natural tratadas con el extracto de S. indicus.13
 Cada uno de estos extractos también mejoró la lipólisis (o quema de grasa) hasta en un 56 % en comparación con las células de control.13
Cada uno de estos extractos también mejoró la lipólisis (o quema de grasa) hasta en un 56 % en comparación con las células de control.13
Habiendo identificado estas propiedades unificadoras en los dos extractos, los investigadores se propusieron determinar si exhibirían efectos mejorados cuando se usaran en combinación.
Descubrieron que los extractos de S. indicus y mangostán modulan favorablemente la actividad de seis vías genómicas involucradas en la formación y descomposición de las células grasas.13
Sorprendentemente, estos extractos redujeron la expresión de genes que promueven la adipogénesis mientras influyen favorablemente en un gen involucrado en la lipólisis deseable.
El recuadro de esta página muestra cómo estos extractos de plantas, usados solos y combinados, modulan positivamente los marcadores involucrados en la acumulación de grasa celular indeseada al inhibir la adipogénesis y promover la lipólisis.
Dadas estas observaciones, los investigadores reconocieron que esta nueva mezcla de extractos de plantas podría resultar en una pérdida de peso significativa a través de tres mecanismos distintos:
- Evitar que las células grasas "jóvenes" (preadipocitos) se conviertan en células grasas "maduras" (adipocitos);
- Reducir la cantidad de ácidos grasos que podrían absorber los adipocitos;
- Aceleración de la descomposición de las reservas de grasa existentes de los adipocitos hinchados.
El siguiente paso fue determinar si estos extractos de plantas inducirían la pérdida de peso en animales de experimentación y, lo que es más importante, en humanos obesos.
Prevención de la obesidad en roedores
Cuando las ratas adultas jóvenes son alimentadas con una dieta alta en grasas, aumentan de peso rápidamente, tal como lo hacen los humanos.
 T
T
Para investigar los efectos de los extractos de plantas que funcionaron en estudios celulares, los científicos alimentaron a un grupo de ratas adultas jóvenes con una dieta rica en grasas. La mitad de las ratas recibieron el extracto de planta dual mientras que la otra mitad sirvió como grupo de control.13
Al final de las ocho semanas, el grupo de control ganó peso rápidamente. Las ratas alimentadas con una dieta rica en grasas y a las que se les administró el extracto de planta dual, por otro lado, redujeron el aumento de peso corporal en un impresionante 700 %.13
Esto no es sorprendente considerando que estos mismos extractos de plantas bloquearon la acumulación de grasa en un 48,5 % y un 65,9 % en el modelo celular.13
Este estudio demostró que estos extractos de plantas disminuyen la obesidad inducida por la dieta en ratas adultas jóvenes. El verdadero desafío, sin embargo, es si estos mismos extractos de plantas son efectivos en humanos que ya son obesos.
Cómo estos extractos de plantas combaten la sobrecarga de adipocitos
La nueva mezcla de extractos de S. indicus y mangostán inhibe la expansión de nuevas células grasas mientras promueve la descomposición de los lípidos en los adipocitos existentes. Los estudios de laboratorio demuestran los siguientes mecanismos moleculares que permiten a estas dos plantas combatir la sobrecarga de adipocitos:
- Proteína relacionada con la diferenciación de adipocitos (ADRP): estimula la acumulación de lípidos y la formación de gotitas de lípidos en las células grasas.13,14 La reducción de los niveles de ADRP se considera una estrategia novedosa para prevenir o reducir la peligrosa acumulación de grasa, especialmente en el hígado.12,13,15 ,dieciséis
- Proteína 4 de unión a ácidos grasos de adipocitos: también conocida como aP2, transporta los ácidos grasos a las células grasas para su almacenamiento. Los niveles elevados de aP2 están asociados con anomalías en el perfil de lípidos que conducen a la aterosclerosis; también pueden ser un factor de riesgo independiente para el síndrome metabólico y la enfermedad cardiovascular.8,11,17-25
- Perilipina: una proteína que recubre las gotas de lípidos en los adipocitos, protegiendo así su contenido graso para que no se descomponga. La inhibición de la perilipina promueve así la lipólisis, contribuyendo a la reducción del contenido graso de los adipocitos.9,26-28
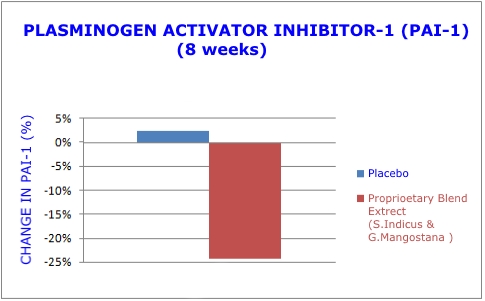
- Inhibidor del activador del plasminógeno-1 (PAI-1): producido principalmente por las células endoteliales (revestimiento de las arterias), el PAI-1 desempeña un papel clave en la formación y descomposición de los coágulos sanguíneos.29 También es secretado por el tejido adiposo.30 Altos niveles de PAI -1, por lo tanto, se correlacionan directamente con la obesidad abdominal, el peso corporal y el índice de masa corporal o IMC.31 En presencia de esta nueva mezcla de extractos de plantas, finalmente se descubrió que los niveles de PAI-1 disminuyeron significativamente.1
- PPAR-gamma (receptor gamma activado por el proliferador de peroxisomas): un "sensor" metabólico primario que desencadena la adipogénesis en presencia de un exceso de calorías.32 La reducción de la actividad de PPAR-gamma ayuda a evitar que las células grasas se hinchen y se vuelvan disfuncionales. 7,9,14,33-36
- Receptor beta-3-adrenérgico (3AR): el extracto de planta dual aumentó la expresión génica de este receptor recientemente descubierto. Regula la descomposición de las grasas (lipólisis) cuando se necesita un refuerzo de energía. Activar el receptor beta-3 de forma espontánea y espectacular aumenta el gasto de energía de las células grasas, quemando la grasa no utilizada en el proceso.6,37-41
Los investigadores han demostrado que las seis vías genómicas involucradas en la formación y descomposición de las células grasas (descritas anteriormente) se modulan favorablemente cuando se exponen a S. indicus y extractos de mangostán.17 Esto proporciona una base científica para explicar los efectos contra la obesidad observados en ensayos clínicos en humanos. .
Hallazgos de pérdida de peso en humanos
Los estudios de pérdida de peso en humanos comprenden un brazo activo que recibió el agente reductor de grasa potencialmente eficaz y un grupo similar que recibió un placebo inactivo.
Para evaluar los efectos de estos dos extractos de plantas, se reclutaron 60 adultos obesos y se dividieron en dos grupos. Un brazo de 30 pacientes funcionó como grupo placebo mientras que un segundo grupo de 30 pacientes recibió 800 mg por día de una combinación de los dos extractos de plantas. Ambos grupos siguieron una dieta de 2000 calorías por día y se les pidió que caminaran 30 minutos cinco días a la semana.
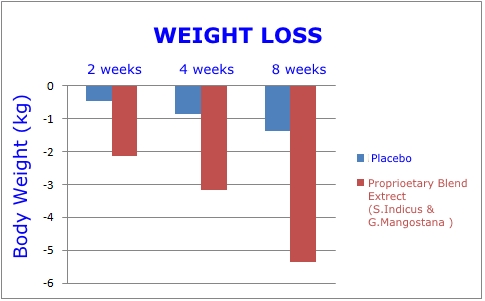
Al cabo de ocho semanas, el grupo que recibió los dos extractos de plantas mostró las siguientes mejoras:1
- Reducción del peso corporal total de 11,4 libras. Esto fue 3,7 veces mayor que el grupo de placebo.
- Reducción de 4.05 pulgadas en el abdomen. Esto fue 2 veces mayor que el grupo de placebo.
- Reducción del índice de masa corporal (IMC) de 2,05. Una disminución 3,9 veces mayor que el grupo placebo.
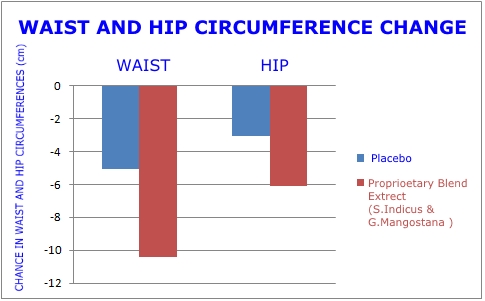
Este fue un estudio aleatorizado, doble ciego, controlado con placebo, del tipo que exige la FDA antes de aprobar nuevos medicamentos. Los gráficos de esta página revelan la magnitud de la pérdida de peso y la reducción de la grasa abdominal que se produjo en el grupo que recibió el extracto de planta dual en comparación con el placebo.1
 Además de los resultados favorables observados a las ocho semanas, los investigadores quedaron impresionados con la reducción de la circunferencia de la cintura y la cadera, así como con la pérdida de peso corporal que se produjo en los primeros 14 días. De hecho, después de solo dos semanas, la reducción de peso promedio fue de 4.6 libras.1
Además de los resultados favorables observados a las ocho semanas, los investigadores quedaron impresionados con la reducción de la circunferencia de la cintura y la cadera, así como con la pérdida de peso corporal que se produjo en los primeros 14 días. De hecho, después de solo dos semanas, la reducción de peso promedio fue de 4.6 libras.1
A las ocho semanas, el grupo de extracto de planta dual mostró una reducción en la relación cintura-cadera que fue 2,2 veces mayor que el grupo de placebo. Esta es una mejora importante, ya que indica que se está perdiendo grasa abdominal visceral peligrosa.
Estos hallazgos están respaldados por un segundo ensayo diseñado de manera similar que involucró a 60 sujetos obesos. Se dividieron en tres grupos que consistían en un brazo de placebo, un brazo activo que recibió un extracto de planta y otro brazo activo que recibió un extracto de planta dual. Todos los participantes siguieron una dieta de 2000 calorías por día y se les pidió que caminaran 30 minutos cinco veces a la semana durante 8 semanas.13
Después de ocho semanas, el grupo que recibió el extracto de planta dual experimentó cambios estadísticamente significativos en su circunferencia abdominal, peso corporal total y circunferencia de la cadera similares a los observados en el primer estudio mencionado anteriormente.13
Estos hallazgos confirmatorios indican que este novedoso extracto de planta dual puede permitir que los humanos mayores eliminen de forma segura las reservas de grasa corporal no deseadas. No se informaron eventos adversos importantes ni efectos secundarios en ninguno de los estudios.
Protección contra la Trombosis Coronaria
 La mayoría de los ataques cardíacos de muerte súbita ocurren cuando se forma un coágulo de sangre en una arteria coronaria, obstruyendo el paso de sangre oxigenada a una parte del músculo cardíaco.
La mayoría de los ataques cardíacos de muerte súbita ocurren cuando se forma un coágulo de sangre en una arteria coronaria, obstruyendo el paso de sangre oxigenada a una parte del músculo cardíaco.
Una proteína llamada inhibidor del activador del plasminógeno-1 (PAI-1) inhibe la descomposición normal de los coágulos sanguíneos arteriales.29 Se observan niveles altos de PAI-1 en personas obesas y se asocian con un mayor riesgo de ataque cardíaco.30,31
Al estudiar el extracto de planta dual, los investigadores midieron los niveles séricos del inhibidor del activador del plasminógeno-1 (PAI-1). Los que recibieron el extracto de planta doble mostraron una reducción del 24,3 % en los niveles peligrosos de PAI-1, mientras que el grupo del placebo mostró un aumento del 2,4 %.1 (Consulte el gráfico 3)
Aquellos suplementados con el extracto de planta dual tuvieron una caída del 60 % en los niveles de triglicéridos en comparación con la línea de base.1
Los sujetos que recibieron el extracto de planta dual aumentaron los niveles de la hormona metabólica clave adiponectina.1 La adiponectina regula la cantidad de azúcar en el torrente sanguíneo y la rapidez con la que el cuerpo descompone la grasa. En términos de pérdida de grasa, son deseables altos niveles de adiponectina. Los niveles más altos de adiponectina se asocian con una disminución de los depósitos de grasa corporal y una menor susceptibilidad a la diabetes y el síndrome metabólico.42
El grupo de extractos de plantas duales mostró tendencias hacia la reducción de glucosa y colesterol, que se espera que ocurran en respuesta a la pérdida de grasa abdominal y peso corporal.1
La pérdida de grasa visceral en el grupo del extracto doble (4,05 pulgadas, equivalente al doble de la disminución observada en el grupo del placebo) es convincente.1 Esto es importante porque la grasa visceral libera una tormenta de moléculas de señalización celular proinflamatorias. El exceso de grasa visceral es un factor de riesgo conocido de una serie de amenazas graves para la salud, que van desde la inflamación sistémica hasta un mayor riesgo de hipertensión, aterosclerosis, diabetes tipo 2 y enfermedad de las arterias coronarias.43-45
En conjunto, estos hallazgos indican un riesgo de enfermedad vascular notablemente reducido en personas obesas que toman 800 mg al día de este extracto de planta dual.
Potentes propiedades antidiabéticas
 Muy apreciados en la medicina ayurvédica tradicional por sus propiedades para inducir la pérdida de peso, los científicos confirmaron que los extractos de Sphaeranthus indicus (S. indicus) y la fruta del mangostán (Garcinia mangostana) ejercen un efecto antidiabético en los humanos.
Muy apreciados en la medicina ayurvédica tradicional por sus propiedades para inducir la pérdida de peso, los científicos confirmaron que los extractos de Sphaeranthus indicus (S. indicus) y la fruta del mangostán (Garcinia mangostana) ejercen un efecto antidiabético en los humanos.
S. indicus se ha utilizado durante siglos para combatir los síntomas de la diabetes, proteger el hígado, calmar la inflamación, mejorar el estado de ánimo y ayudar en la digestión.46
Los animales de laboratorio diabéticos tratados con extractos de S. indicus exhiben reducciones sustanciales en la glucosa en sangre, junto con una mejor función hepática y pancreática.47,48 En ratones resistentes a la insulina, los extractos de S. indicus reducen los niveles de azúcar en sangre y triglicéridos al tiempo que facilitan una absorción más eficiente de glucosa en el tejido muscular.49 Los animales diabéticos tratados con S. indicus exhiben niveles significativamente más bajos de oxidación tisular,50 un factor subyacente importante en la mayoría de las complicaciones diabéticas que amenazan la vida.48,49
El mangostán es una fruta comestible que crece en todo el sur de Asia. Al igual que S. indicus, partes de la fruta y su jugo se han utilizado durante siglos para combatir la diabetes y la obesidad. Un mecanismo vital es su capacidad para bloquear la enzima metabólica crítica alfa-amilasa que descompone los almidones en azúcar.51 Los bloqueadores de alfa-amilasa limitan el pico en los niveles de glucosa en sangre que normalmente seguiría a una comida rica en carbohidratos. Los extractos de mangostán también inhiben las enzimas involucradas en la síntesis de moléculas de grasa.33 Es esta combinación de bloquear la absorción de azúcar y bloquear la producción de grasa lo que explica en parte sus propiedades inductoras de pérdida de peso.
Los extractos de mangostán tienen un beneficio adicional notable. Se ha demostrado que limitan eficazmente la inflamación que suele acompañar a la acumulación de células grasas.6,52 Esta inflamación contribuye directamente a la resistencia a la insulina. En un estudio convincente, los niveles del marcador inflamatorio proteína C reactiva disminuyeron significativamente53 en personas obesas que consumieron jugo de mangostán después de solo 8 semanas.
Resumen
La obesidad surge del aumento de tamaño de los adipocitos individuales (células grasas) debido a una mayor acumulación de lípidos (grasa). Empeora a medida que un mayor número de preadipocitos se transforman en adipocitos hinchados y disfuncionales.
La nueva mezcla de extractos de plantas descrita en este artículo influye favorablemente en seis vías distintas por las cuales las células grasas desencadenan el aumento de peso.
En cultivo celular, estos extractos de plantas reducen la capacidad de las células grasas progenitoras (preadipocitos) para transformarse en células grasas hinchadas. Estos estudios también muestran que los componentes de este extracto vegetal dual reducen la cantidad de ácidos grasos absorbidos por los adipocitos (adipogénesis) y facilitan la descomposición (lipólisis) de la grasa almacenada en los adipocitos existentes.
En un ensayo clínico controlado con placebo que involucró a humanos obesos, esta mezcla de S. indicus y extractos de plantas de mangostán indujo de manera segura una pérdida de peso de 11.4 libras, junto con una disminución de 2.05 en el índice de masa corporal (IMC) y una reducción de 4.05 pulgadas en grasa visceral.1
Si bien nuestro establecimiento médico no ha podido ofrecer ninguna solución práctica, segura y a largo plazo para la epidemia de obesidad actual, ahora hay agentes naturales disponibles que aumentan sustancialmente los efectos de un programa de pérdida de peso sensato.
Material utilizado con permiso de Life Extension. Reservados todos los derechos.
1. Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
2. Bunnell BA, Estes BT, Guilak F, Gimble JM. Differentiation of adipose stem cells. Methods Mol Biol. 2008;456:155-71.
3. Symonds ME, Budge H, Perkins AC, Lomax MA. Adipose tissue development – Impact of the early life environment. Prog Biophys Mol Biol. 2010 Dec 14.
4. Takakura Y, Yoshida T. Beta 3-adrenergic receptor agonists–past, present and future. Nippon Yakurigaku Zasshi. 2001 Nov;118(5):315-20.
5. Xiao L, Zhang J, Li H, Liu J, He L, Zhai Y. Inhibition of adipocyte differentiation and adipogenesis by the traditional Chinese herb Sibiraea angustata. Exp Biol Med (Maywood). 2010 Dec;235(12):1442-9.
6. Bumrungpert A, Kalpravidh RW, Chuang CC, et al. Xanthones from mangosteen inhibit inflammation in human macrophages and in human adipocytes exposed to macrophage-conditioned media. J Nutr. 2010 Apr;140 (4):842-7.
7. Amini Z, Boyd B, Doucet J, Ribnicky DM, Stephens JM. St. John’s Wort inhibits adipocyte differentiation and induces insulin resistance in adipocytes. Biochem Biophys Res Commun. 2009 Oct 9;388(1):146-9.
8. Frayn KN, Fielding BA, Karpe F. Adipose tissue fatty acid metabolism and cardiovascular disease. Curr Opin Lipidol. 2005 Aug;16(4):409-15.
9. Wang S, Soni KG, Semache M, et al. Lipolysis and the integrated physiology of lipid energy metabolism. Mol Genet Metab. 2008 Nov;95(3):117-26.
10. Lee J, Jung E, Huh S, Kim YS, Kim YW, Park D. Anti-adipogenesis by 6-thioinosine is mediated by downregulation of PPAR gamma through JNK-dependent upregulation of iNOS. Cell Mol Life Sci. 2010 Feb;67(3):467-81.
11. Smas CM, Sul HS. Molecular mechanisms of adipocyte differentiation and inhibitory action of pref-1. Crit Rev Eukaryot Gene Expr. 1997;7(4):281-98.
12. Fan B, Ikuyama S, Gu JQ, et al. Oleic acid-induced ADRP expression requires both AP-1 and PPAR response elements, and is reduced by Pycnogenol through mRNA degradation in NMuLi liver cells. Am J Physiol Endocrinol Metab. 2009 Jul;297(1):E112-23.
13. Results based on initial analyses of unpublished research data.
14. Imamura M, Inoguchi T, Ikuyama S, et al. ADRP stimulates lipid accumulation and lipid droplet formation in murine fibroblasts. Am J Physiol Endocrinol Metab. 2002 Oct;283(4):E775-83.
15. Grasselli E, Voci A, Canesi L, et al. Direct effects of iodothyronines on excess fat storage in rat hepatocytes. J Hepatol. 2010 Nov 3.
16. Imai Y, Varela GM, Jackson MB, Graham MJ, Crooke RM, Ahima RS. Reduction of hepatosteatosis and lipid levels by an adipose differentiation-related protein antisense oligonucleotide. Gastroenterology. 2007 May;132(5):1947-54.
17. Agardh HE, Folkersen L, Ekstrand J, et al. Expression of fatty acid-binding protein 4/aP2 is correlated with plaque instability in carotid atherosclerosis. J Intern Med. 2011 Feb;269(2):200-10.
18. Aragones G, Ferre R, Lazaro I, et al. Fatty acid-binding protein 4 is associated with endothelial dysfunction in patients with type 2 diabetes. Atherosclerosis. 2010 Nov;213(1):329-31.
19. Cabre A, Lazaro I, Cofan M, et al. FABP4 plasma levels are increased in familial combined hyperlipidemia. J Lipid Res. 2010 May;51(5):1173-8.
20. Cabre A, Lazaro I, Girona J, et al. Plasma fatty acid binding protein 4 is associated with atherogenic dyslipidemia in diabetes. J Lipid Res. 2008 Aug;49(8):1746-51.
21. Chmurzynska A. The multigene family of fatty acid-binding proteins (FABPs): function, structure and polymorphism. J Appl Genet. 2006;47(1):39-48.
22. Karakas SE, Almario RU, Kim K. Serum fatty acid binding protein 4, free fatty acids, and metabolic risk markers. Metabolism. 2009 Jul;58(7):1002-7.
23. Kersten S. Mechanisms of nutritional and hormonal regulation of lipogenesis. EMBO Rep. 2001 Apr;2(4):282-6.
24. Toruner F, Altinova AE, Akturk M, et al. The relationship between adipocyte fatty acid binding protein-4, retinol binding protein-4 levels and early diabetic nephropathy in patients with type 2 diabetes. Diabetes Res Clin Pract. 2010 Dec 19.
25. Tsai JP, Liou HH, Liu HM, Lee CJ, Lee RP, Hsu BG. Fasting serum fatty acid-binding protein 4 level positively correlates with metabolic syndrome in hemodialysis patients. Arch Med Res. 2010 Oct;41(7):536-40.
26. Li Y, Kang Z, Li S, Kong T, Liu X, Sun C. Ursolic acid stimulates lipolysis in primary-cultured rat adipocytes. Mol Nutr Food Res. 2010 Nov;54(11):1609-17.
27. Nerurkar PV, Lee YK, Nerurkar VR. Momordica charantia (bitter melon) inhibits primary human adipocyte differentiation by modulating adipogenic genes. BMC Complement Altern Med. 2010;10:34.
28. Tinahones FJ, Garrido-Sanchez L, Miranda M, et al. Obesity and insulin resistance-related changes in the expression of lipogenic and lipolytic genes in morbidly obese subjects. Obes Surg. 2010 Nov;20(11):1559-67.
29. Mutch NJ, Thomas L, Moore NR, Lisiak KM, Booth NA. TAFIa, PAI-1 and alpha-antiplasmin: complementary roles in regulating lysis of thrombi and plasma clots. J Thromb Haemost. 2007 Apr;5(4):812-7.
30. Trayhurn P, Wood IS. Signalling role of adipose tissue: adipokines and inflammation in obesity. Biochem Soc Trans. 2005 Nov;33(Pt 5):1078-81.
31. Gnacinska M, Malgorzewicz S, Guzek M, Lysiak-Szydłowska W, Sworczak K. Adipose tissue activity in relation to overweight or obesity. Endokrynol Pol. 2010 Mar-Apr;61(2):160-8.
32. Cock TA, Houten SM, Auwerx J. Peroxisome proliferator-activated receptor-gamma: too much of a good thing causes harm. EMBO Rep. 2004 Feb;5(2):142-7.
33. Jiang HZ, Quan XF, Tian WX, et al. Fatty acid synthase inhibitors of phenolic constituents isolated from Garcinia mangostana. Bioorg Med Chem Lett. 2010 Oct 15;20(20):6045-7.
34. Choi JH, Banks AS, Estall JL, et al. Anti-diabetic drugs inhibit obesity-linked phosphorylation of PPARgamma by Cdk5. Nature. 2010 Jul 22;466(7305):451-6.
35. Oben JE, Ngondi JL, Blum K. Inhibition of Irvingia gabonensis seed extract (OB131) on adipogenesis as mediated via down regulation of the PPARgamma and leptin genes and up-regulation of the adiponectin gene. Lipids Health Dis. 2008;7:44.
36. Tsukahara T, Hanazawa S, Murakami-Murofushi K. Cyclic phosphatidic acid influences the expression and regulation of cyclic nucleotide phosphodiesterase 3B and lipolysis in 3T3-L1 cells. Biochem Biophys Res Commun. 2011 Jan 7;404(1):109-14.
37. An S, Han JI, Kim MJ, et al. Ethanolic extracts of Brassica campestris spp. rapa roots prevent high-fat diet-induced obesity via beta(3)-adrenergic regulation of white adipocyte lipolytic activity. J Med Food. 2010 Apr;13(2):406-14.
38. Hatakeyama Y, Sakata Y, Takakura S, Manda T, Mutoh S. Acute and chronic effects of FR-149175, a beta 3-adrenergic receptor agonist, on energy expenditure in Zucker fatty rats. Am J Physiol Regul Integr Comp Physiol. 2004 Aug;287(2):R336-41.
39. Lima JJ, Feng H, Duckworth L, et al. Association analyses of adrenergic receptor polymorphisms with obesity and metabolic alterations. Metabolism. 2007 Jun;56(6):757-65.
40. Sakura H, Togashi M, Iwamoto Y. Beta 3-adrenergic receptor agonists as anti-obese and anti-diabetic drugs. Nippon Rinsho. 2002 Jan;60(1):123-9.
41. van Baak MA, Hul GB, Toubro S, et al. Acute effect of L-796568, a novel beta 3-adrenergic receptor agonist, on energy expenditure in obese men. Clin Pharmacol Ther. 2002 Apr;71(4):272-9.
42. Ukkola O, Santaniemi M. Adiponectin: a link between excess adiposity and associated comorbidities? J Mol Med. 2002 Nov;80(11):696-702.
43. Koh H, Hayashi T, Sato KK, et al. Visceral adiposity, not abdominal subcutaneous fat area, is associated with high blood pressure in Japanese men: the Ohtori study. Hypertens Res. 2011 Jan 13.
44. Lee YH, Lee SH, Jung ES, et al. Visceral adiposity and the severity of coronary artery disease in middle-aged subjects with normal waist circumference and its relation with lipocalin-2 and MCP-1. Atherosclerosis. 2010 Dec;213(2):592-7.
45. Navarro E, Mijac V, Ryder HF. Ultrasonography measurement of intrabdominal visceral fat in obese men. Association with alterations in serum lipids and insulinemia. Arch Latinoam Nutr. 2010 Jun;60(2):160-7.
46. Galani VJ, Patel BG, Rana DG. Sphaeranthus indicus Linn.: A phytopharmacological review. Int J Ayurveda Res. 2010 Oct;1(4):247-53.
47. Prabhu KS, Lobo R, Shirwaikar A. Antidiabetic properties of the alcoholic extract of Sphaeranthus indicus in streptozotocin-nicotinamide diabetic rats. J Pharm Pharmacol. 2008 Jul;60(7):909-16.
48. Ramachandran S, Asokkumar K, Uma Maheswari M, et al. Investigation of Antidiabetic, Antihyperlipidemic, and In Vivo Antioxidant Properties of Sphaeranthus indicus Linn. in Type 1 Diabetic Rats: An Identification of Possible Biomarkers. Evid Based Complement Alternat Med. 2011;2011.
49. Ghaisas M, Zope V, Takawale A, Navghare V, Tanwar M, Deshpande A. Preventive effect of Sphaeranthus indicus during progression of glucocorticoid-induced insulin resistance in mice. Pharm Biol. 2010 Dec;48(12):1371-5.
50. Shirwaikar A, Prabhu KS, Punitha IS. In vitro antioxidant studies of Sphaeranthus indicus (Linn). Indian J Exp Biol. 2006 Dec;44(12):993-6.
51. Loo AE, Huang D. Assay-guided fractionation study of alpha-amylase inhibitors from Garcinia mangostana pericarp. J Agric Food Chem. 2007 Nov 28;55(24):9805-10.
52. Bumrungpert A, Kalpravidh RW, Chitchumroonchokchai C, et al. Xanthones from mangosteen prevent lipopolysaccharide-mediated inflammation and insulin resistance in primary cultures of human adipocytes. J Nutr. 2009 Jun;139(6):1185-91.
53. Udani JK, Singh BB, Barrett ML, Singh VJ. Evaluation of Mangosteen juice blend on biomarkers of inflammation in obese subjects: a pilot, dose finding study. Nutr J. 2009;8:48.


