Perdre du poids en inhibant le stockage de graisse cellulaire
 Les autorités sanitaires mettent en garde contre les conséquences dévastatrices de l'obésité, mais les médecins ignorent ce qui pousse les gens à accumuler autant de livres de graisse en vieillissant.
Les autorités sanitaires mettent en garde contre les conséquences dévastatrices de l'obésité, mais les médecins ignorent ce qui pousse les gens à accumuler autant de livres de graisse en vieillissant.
À travers une série d’études bien conçues, des scientifiques ont découvert que certains extraits de plantes pouvaient bloquer le stockage des graisses au niveau cellulaire.
Dans le cadre d'une avancée scientifique significative, une nouvelle arme puissante a été identifiée pour aider à induire une perte de poids en toute sécurité.
Cet article décrit comment un nouvel extrait de double plante module favorablement six voies que les cellules adipeuses utilisent pour déclencher un gain de poids.
Lors d'essais menés sur des humains dans le cadre d'une étude contrôlée par placebo, ceux qui prenaient cet extrait de plante double ont perdu 4,05 pouces de graisse abdominale et 11,4 kilos après huit semaines… avec une perte de poids observée dès 14 jours.1
Les cellules qui stockent la graisse s'appellent des adipocytes. Ils sont déposés dans tout notre corps.2,3
En vieillissant, les adipocytes ont tendance à se dilater et à se rassembler dans des zones inesthétiques sur le plan cosmétique et préjudiciables à notre santé.
Les adipocytes qui se déposent au plus profond de notre abdomen sont particulièrement préoccupants. Cette «graisse viscérale» représente plus que la graisse stockée dans notre tour de taille. La graisse viscérale est un tissu chimiquement actif qui produit un torrent de cytokines pro-inflammatoires4.
Ceux qui ont le ventre bombé subissent un bombardement constant de cytokines toxiques qui déclenchent le syndrome métabolique et ses conséquences mortelles5,6.
Ce problème répandu a conduit les scientifiques à rechercher des extraits de plantes qui interfèrent spécifiquement avec le stockage de la graisse adipocytaire dans notre anatomie abdominale.
Comment se produit le stockage de graisse indésirable
 Les calories en excès se transforment en graisse dans les adipocytes7 selon un processus en plusieurs étapes appelé adipogenèse.
Les calories en excès se transforment en graisse dans les adipocytes7 selon un processus en plusieurs étapes appelé adipogenèse.
Lorsque moins de calories sont consommées, les adipocytes libèrent de la graisse pour répondre aux besoins énergétiques de l’organisme8,9. C’est ce que l’on appelle la lipolyse.
Un extrait de plante double a été étudié pour son aptitude à inhiber simultanément l’adipogenèse (stockage de la graisse) et à améliorer la lipolyse (décomposition et libération de la graisse).
Comme toute autre cellule, les adipocytes se développent à partir de cellules souches indifférenciées. Les cellules adipeuses en développement prématurées sont appelées pré-adipocytes. Lorsque vous ingérez plus de calories que votre corps n'en a besoin, les «jeunes» préadipocytes réagissent en devenant des adipocytes «adultes» 7,10-12.
Les adipocytes «adultes» absorbent les acides gras en excès de votre circulation sanguine et commencent à prendre de l'expansion. C’est ce processus d’absorption d’acides gras et d’expansion des adipocytes qui aboutit à l’obésité et à ses conséquences pathologiques. Chaque excès de calories contribue ainsi à la maturation et à la croissance des cellules graisseuses. Passé un certain point, les adipocytes se distendent et deviennent gonflés, de la même manière que votre ventre.
Tous les adipocytes ne sont pas identiques. Tandis que les cellules graisseuses se répartissent dans tout votre corps, celles qui se logent dans votre abdomen, appelées graisse viscérale ou graisse du ventre, représentent plus que de simples «contenants» de stockage.
Les cellules adipeuses du ventre sont chimiquement actives. Ils forment un tissu adipeux capable de libérer des cytokines pro-inflammatoires nuisibles.4
Chez les individus obèses, la masse excessive de dépôts de graisse viscérale génère un flot pro-inflammatoire de cytokines. Cette libération de cytokines provoque alors une cascade d'effets néfastes qui, si rien n'est fait, contribuent à l'apparition de multiples maladies dégénératives5,6.
Ainsi, le stockage de la graisse corporelle indésirable se produit lorsque les cellules souches préadipocytaires mûrissent afin de stocker l'excès de graisse alimentaire (adipogenèse), tandis que la capacité à décomposer la graisse stockée (lipolyse) diminue.
- Une épidémie d'obésité continue de faire rage dans ce pays, avec plus des deux tiers de la population américaine en surpoids ou obèses.

- La médecine conventionnelle n’a pas encore proposé de solution sûre, pratique et à long terme.
- Des chercheurs de pointe continuent à identifier de nouveaux agents naturels induisant une perte de poids.
- Parmi les plus récents, on trouve un extrait de plante double contenant des extraits de la fleur S. indicus et du mangoustan, tous deux originaires d’Asie.
- Une fois combinés, il a été constaté que le mélange à double extrait résultant influait favorablement sur six voies biomoléculaires distinctes par lesquelles les cellules adipeuses déclenchent un gain de poids.Lors d'essais cliniques contrôlés par placebo portant sur des sujets obèses, cet extrait double induisait en toute sécurité une perte de poids totale de 11,4 livres, une diminution de 2,05 de l'indice de masse corporelle (IMC) et une réduction de 4,05 pouces de graisse viscérale néfaste après seulement huit semaines.1
Combattre le surplus de graisse corporelle
À la recherche d'interventions naturelles qui inhiberaient efficacement l'accumulation de graisses (adipogenèse) et favoriseraient la combustion des graisses (lipolyse), les scientifiques ont évalué plus d'un millier de plantes afin de déterminer si ces critères étaient remplis13.
Deux plantes dont les extraits ont démontré des effets biologiques significatifs étaient:
- Sphaeranthus indicus fleur (S. indicus)13
- Mangoustan fruit (Garcinia mangostana).13
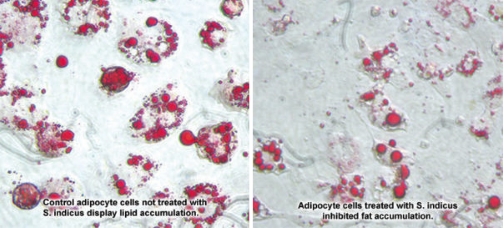
En laboratoire, des extraits de S. indicus et de mangoustan ont fortement empêché l'adipogenèse.
Lorsque les cellules ont été traitées avec S. indicus seul, le stockage des graisses a été inhibé jusqu'à 65%, comparé aux cellules témoins. Les photographies (ci-dessous) montrent une différence nettement visible entre les deux groupes de cellules. Les cellules de contrôle présentent un aspect gonflé et «mousseux», gonflé de gouttelettes de graisse, par rapport aux cellules plus petites et plus naturelles, traitées avec l'extrait de S. indicus.13
 Chacun de ces extraits a également amélioré la lipolyse (ou combustion des graisses) de 56% par rapport aux cellules témoins13.
Chacun de ces extraits a également amélioré la lipolyse (ou combustion des graisses) de 56% par rapport aux cellules témoins13.
Après avoir identifié ces propriétés unifiantes dans les deux extraits, les chercheurs ont cherché à déterminer s’ils présenteraient des effets améliorés s’ils étaient utilisés en combinaison.
Ils ont constaté que les extraits de S. indicus et de mangoustan modulent favorablement l'activité de six voies génomiques impliquées dans la formation et la dégradation des cellules adipeuses.13
De manière remarquable, ces extraits ont réduit l'expression génique qui favorise l'adipogenèse tout en influençant favorablement un gène impliqué dans la lipolyse souhaitable.
L'encadré de cette page montre comment ces extraits de plantes, utilisés seuls ou en association, modulent positivement les marqueurs impliqués dans l'accumulation de graisse cellulaire indésirable en inhibant l'adipogenèse et en favorisant la lipolyse.
Compte tenu de ces observations, les chercheurs ont reconnu que ce nouveau mélange d'extraits de plantes pourrait entraîner une perte de poids importante via trois mécanismes distincts:
- Prévenir la formation de cellules adipeuses «jeunes» (pré-adipocytes) en cellules adipeuses «matures» (adipocytes)
- Réduire la quantité d'acides gras que les adipocytes pourraient absorber;
- Ventilation rapide des réserves de graisse existantes des adipocytes gonflés.
L'étape suivante consistait à déterminer si ces extraits de plantes entraîneraient une perte de poids chez les animaux de laboratoire et, plus important encore, chez les humains obèses.
Prévenir l'obésité chez les rongeurs
Lorsque les jeunes rats adultes suivent un régime riche en graisses, ils prennent rapidement du poids, comme le font souvent les humains.
 Pour étudier les effets des extraits de plantes qui ont fonctionné dans les études sur les cellules, les scientifiques ont administré à un groupe de jeunes rats adultes un régime alimentaire riche en graisses. La moitié des rats ont reçu l'extrait de plantes doubles, tandis que l'autre moitié a servi de groupe témoin13.
Pour étudier les effets des extraits de plantes qui ont fonctionné dans les études sur les cellules, les scientifiques ont administré à un groupe de jeunes rats adultes un régime alimentaire riche en graisses. La moitié des rats ont reçu l'extrait de plantes doubles, tandis que l'autre moitié a servi de groupe témoin13.
Au bout de huit semaines, le groupe témoin a rapidement pris du poids. Les rats qui suivaient un régime riche en graisses et dont l'extrait de plante double présentait un gain de poids corporel impressionnant de 700% 13.
Cela n’est pas surprenant si l’on considère que ces mêmes extraits de plantes ont bloqué l’accumulation de graisse de 48,5% et de 65,9% dans le modèle cellulaire.13
Cette étude a démontré que ces extraits de plantes diminuent l'obésité d'origine alimentaire chez les jeunes rats adultes. Le véritable défi, cependant, est de savoir si ces mêmes extraits de plantes sont efficaces chez les humains déjà obèses.
Le nouveau mélange d'extraits de S. indicus et de mangoustan inhibe l'expansion de nouvelles cellules adipeuses tout en favorisant la dégradation des lipides dans les adipocytes existants. Les études de laboratoire démontrent les mécanismes moléculaires suivants qui permettent à ces deux plantes de lutter contre la surcharge adipocytaire:
- Protéine liée à la différenciation adipocytaire (ADRP): stimule l'accumulation de lipides et la formation de gouttelettes lipidiques dans les cellules adipeuses.13,14 La réduction des niveaux d'ADRP est considérée comme une nouvelle stratégie pour prévenir ou réduire l'accumulation dangereuse de graisse, en particulier dans le foie.12,13,15,16
- Protéine de liaison aux acides gras des adipocytes 4: également appelée aP2, elle transporte les acides gras dans les cellules adipeuses pour les stocker. Des niveaux accrus de aP2 sont associés à des anomalies du profil lipidique conduisant à l’athérosclérose; ils peuvent également constituer un facteur de risque indépendant du syndrome métabolique et des maladies cardiovasculaires.8,11,17-25
- Périlipine: Une protéine qui recouvre les gouttelettes lipidiques dans les adipocytes, protégeant ainsi leur teneur en graisse de la dégradation. L'inhibition de la périlipine favorise donc la lipolyse, contribuant à une réduction de la teneur en graisse des adipocytes.9,26-28
- Activateur de plasminogène inhibiteur-1 (PAI-1): Produit principalement par les cellules endothéliales (artérielles), le PAI-1 joue un rôle clé dans la formation et la décomposition de caillots sanguins.29 Il est également sécrété par le tissu adipeux.30Les niveaux élevés de PAI-1 sont donc directement corrélés à l'obésité abdominale, au poids corporel et à l'indice de masse corporelle ou à l'IMC31. En présence de ce nouveau mélange d'extraits de plantes, il a finalement été constaté que les niveaux de PAI-1 diminuaient de manière significative.1
- PPAR-gamma (récepteur-gamma activé par les proliférateurs de peroxysomes): il s'agit d'un «capteur» métabolique primaire qui déclenche l'adipogenèse en présence d'excès de calories.32 La réduction de l'activité de PPAR-gamma aide à prévenir le gonflement et le dysfonctionnement des cellules adipeuses.. 7,9,14,33-36
- Récepteur bêta-3-adrénergique (3AR): L'expression génique de ce récepteur récemment découvert a été augmentée par l'extrait de plante double. Il régule la dégradation des graisses (lipolyse) lorsqu'un regain d'énergie est nécessaire. L'activation du récepteur bêta-3 augmente de façon spontanée et spectaculaire la dépense énergétique des cellules adipeuses, brûlant ainsi la graisse inutilisée.6,37-41
Les chercheurs ont démontré que les six voies génomiques impliquées dans la formation et la dégradation des cellules adipeuses (décrites ci-dessus) sont modulées de manière favorable lorsqu'elles sont exposées à des extraits de S. indicus et de mangoustan.17 Ceci fournit une base scientifique pour expliquer les effets anti-obésité observés dans les essais cliniques humains.
Résultats de perte de poids chez les humains
Les études de perte de poids chez l’homme comprennent un bras actif recevant l’agent réducteur de graisse potentiellement efficace et un groupe similaire recevant un placebo inactif.
Pour évaluer les effets de ces deux extraits de plantes, 60 adultes obèses ont été recrutés et divisés en deux groupes. Un groupe de 30 patients a fonctionné comme groupe placebo tandis qu'un deuxième groupe de 30 patients a reçu 800 mg par jour d'une combinaison des deux extraits de plantes. Les deux groupes suivaient un régime de 2 000 calories par jour et devaient marcher 30 minutes cinq jours par semaine.
Au bout de huit semaines, le groupe recevant les deux extraits de plantes a présenté les améliorations suivantes: 1
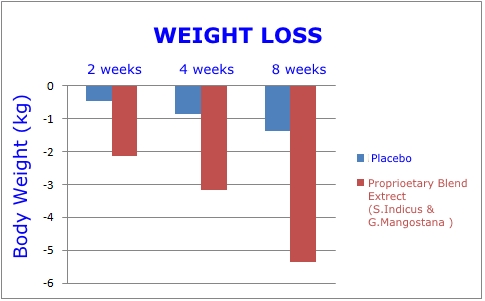
- Réduction du poids corporel total de 11,4 livres. C'était 3,7 fois plus que le groupe placebo.
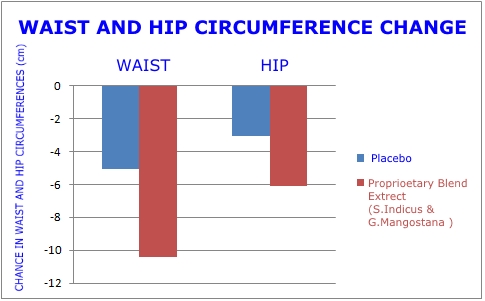
- Réduction de 4,05 pouces dans l'abdomen. C'était 2 fois plus que le groupe placebo.
- Réduction de l'indice de masse corporelle (IMC) de 2,05. Une diminution 3,9 fois supérieure à celle du groupe placebo.
 Il s'agissait d'une étude randomisée, à double insu, contrôlée par placebo, du genre que la FDA exige avant d'autoriser de nouveaux médicaments. Les graphiques de cette page révèlent l’ampleur de la perte de poids et de la réduction de la graisse du ventre survenues dans le groupe recevant l’extrait de plante double par rapport au placebo.1
Il s'agissait d'une étude randomisée, à double insu, contrôlée par placebo, du genre que la FDA exige avant d'autoriser de nouveaux médicaments. Les graphiques de cette page révèlent l’ampleur de la perte de poids et de la réduction de la graisse du ventre survenues dans le groupe recevant l’extrait de plante double par rapport au placebo.1
En plus des résultats favorables observés après huit semaines, les chercheurs ont été impressionnés par la réduction du tour de taille et du tour de hanche, ainsi que par la perte de poids corporel survenue au cours des 14 premiers jours! En fait, après seulement deux semaines, la réduction de poids moyenne était de 4,6 livres.1
À huit semaines, le groupe des extraits de plantes doubles présentait une réduction du rapport taille / hanche de 2,2 fois supérieure à celle du groupe placebo. Ceci est une amélioration importante car il indique que la graisse du ventre viscérale dangereuse est en train de disparaître.
Ces résultats sont corroborés par un deuxième essai similaire, mené sur 60 sujets obèses. Ils ont été divisés en trois groupes: un bras placebo, un bras actif recevant un extrait de plante et un autre bras actif recevant un extrait de plante double. Tous les participants suivaient un régime de 2 000 calories par jour et devaient marcher 30 minutes cinq fois par semaine pendant 8 semaines13.
Après huit semaines, le groupe recevant l'extrait de plante double a présenté des modifications statistiquement significatives de la circonférence abdominale, du poids total du corps et de la circonférence de la hanche similaires à celles observées dans la première étude susmentionnée13.
Ces résultats de confirmation indiquent que cet extrait de plante double innovant pourrait permettre à des personnes âgées de se débarrasser en toute sécurité des réserves de graisse corporelle indésirables. Aucun événement indésirable majeur ou effet secondaire n'a été rapporté dans les deux études.
Protection contre la thrombose coronaire
 La plupart des crises cardiaques provoquant la mort subite se produisent lorsqu'un caillot sanguin se forme dans une artère coronaire, étouffant le sang oxygéné d'une partie du muscle cardiaque.
La plupart des crises cardiaques provoquant la mort subite se produisent lorsqu'un caillot sanguin se forme dans une artère coronaire, étouffant le sang oxygéné d'une partie du muscle cardiaque.
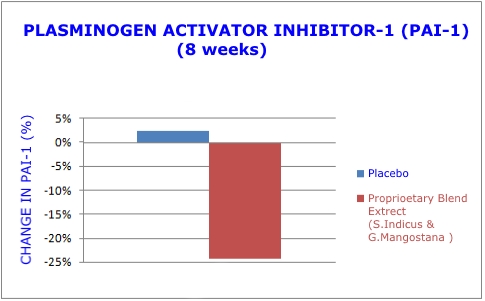
Une protéine appelée inhibiteur de l'activateur de plasminogène-1 (PAI-1) inhibe la dégradation normale des caillots sanguins artériels29. Des niveaux élevés de PAI-1 sont observés chez les individus obèses et sont associés à un risque accru de crise cardiaque.30,31
Lors de l'étude de l'extrait de plante double, les chercheurs ont mesuré les taux sériques d'inhibiteur de l'activateur de plasminogène-1 (PAI-1). Ceux recevant l'extrait de plante double ont présenté une réduction de 24,3% des niveaux dangereux de PAI-1, tandis que le groupe placebo a présenté une augmentation de 2,4% 1 (voir le graphique 3).
Celles qui ont reçu l’extrait de plante double ont présenté une chute de 60% des taux de triglycérides par rapport au niveau de référence.1
Les sujets ayant reçu l'extrait de plante double ont augmenté les niveaux de l'adiponectine, une hormone métabolique essentielle.1 L'adiponectine régule la quantité de sucre dans le sang et la rapidité avec laquelle votre corps décompose les graisses. En termes de perte de graisse, des niveaux élevés d'adiponectine sont souhaitables. Des niveaux plus élevés d'adiponectine sont associés à une diminution des dépôts de graisse corporelle et à une susceptibilité réduite au diabète et au syndrome métabolique42.
Le groupe d'extraits de plantes doubles a montré une tendance à la réduction du glucose et du cholestérol, qui devraient se produire en réponse à la perte de graisse du ventre et au poids corporel.1
La perte de graisse viscérale dans le groupe du double extrait, soit 4,05 pouces, soit le double du déclin observé dans le groupe placebo, est convaincante.1 Ceci est important car la graisse viscérale libère une tempête de molécules de signalisation cellulaire pro-inflammatoires. L'excès de graisse viscérale est un facteur de risque connu pour un certain nombre de menaces graves pour la santé, allant d'une inflammation systémique à un risque accru d'hypertension, d'athérosclérose, de diabète de type 2 et de maladie coronarienne.43-45
Pris ensemble, ces résultats indiquent une nette diminution du risque de maladies vasculaires chez les individus obèses prenant 800 mg par jour de cet extrait de plante double.
Propriétés antidiabétiques puissantes
 Reconnus depuis longtemps en médecine ayurvédique traditionnelle pour leurs propriétés amincissantes, les scientifiques ont confirmé que les extraits de Sphaeranthus indicus (S. indicus) et de mangoustan (Garcinia mangostana) exercent un effet antidiabétique chez l'homme.
Reconnus depuis longtemps en médecine ayurvédique traditionnelle pour leurs propriétés amincissantes, les scientifiques ont confirmé que les extraits de Sphaeranthus indicus (S. indicus) et de mangoustan (Garcinia mangostana) exercent un effet antidiabétique chez l'homme.
S. indicus est utilisé depuis des siècles pour combattre les symptômes du diabète, protéger le foie, réprimer l'inflammation, stimuler l'humeur et faciliter la digestion 46.
Les animaux de laboratoire diabétiques traités avec des extraits de S. indicus présentent une réduction importante de la glycémie, ainsi qu'une amélioration de la fonction hépatique et pancréatique.47,48 Chez les souris résistantes à l'insuline, S. indicus extrait des taux de sucre dans le sang et de triglycérides inférieurs tout en facilitant une absorption plus efficace du glucose dans les tissus musculaires.49 Les animaux diabétiques traités avec S. indicus présentent des niveaux significativement plus bas d'oxydation des tissus50, facteur majeur sous-jacent de la plupart des complications du diabète potentiellement mortelles.48,49
Le mangoustan est un fruit comestible qui pousse dans toute l'Asie du Sud. Comme S. indicus, des parties du fruit et de son jus sont utilisés depuis des siècles pour lutter contre le diabète et l'obésité. Un mécanisme essentiel est sa capacité à bloquer l'enzyme métabolique critique alpha-amylase qui décompose l'amidon en sucre51. Les bloqueurs d'alpha-amylase limitent les pointes de glycémie qui suivraient normalement un repas riche en glucides. Les extraits de mangoustan inhibent également les enzymes impliquées dans la synthèse des molécules de graisse33. C'est cette combinaison de blocage de l'absorption de sucre et de la production de graisse qui explique en partie ses propriétés induisant une perte de poids.
Les extraits de mangoustan ont un avantage supplémentaire remarquable. Il a été démontré qu'ils limitent efficacement l'inflammation qui accompagne généralement l'accumulation de cellules adipeuses6,52. Cette inflammation contribue directement à la résistance à l'insuline. Dans une étude convaincante, les taux de protéine C-réactive, marqueur inflammatoire, ont diminué significativement53 chez les individus obèses consommant du jus de mangoustan après seulement 8 semaines.
Résumé
L'obésité découle de la taille accrue des adipocytes (cellules adipeuses) en raison de l'accumulation accrue de lipides (graisses). Elle s'aggrave à mesure qu'un plus grand nombre de pré-adipocytes se transforme en adipocytes dysfonctionnels et gonflés.
Le nouveau mélange d'extraits de plantes décrit dans cet article influence favorablement six voies distinctes par lesquelles les cellules adipeuses déclenchent un gain de poids.
En culture cellulaire, ces extraits de plantes réduisent la capacité des cellules graisseuses progénitrices (pré-adipocytes) à se transformer en cellules graisseuses gonflées. Ces études montrent également que les composants de cet extrait végétal double réduisent la quantité d'acides gras absorbés par les adipocytes (adipogenèse) et facilitent la dégradation (lipolyse) de la graisse stockée dans les adipocytes existants.
Dans un essai clinique contrôlé par placebo portant sur des humains obèses, ce mélange d'extraits de plantes de S. indicus et de mangoustan a induit une perte de poids de 11,4 livres, ainsi qu'une baisse de 2,05 de l'indice de masse corporelle (IMC) et une réduction de 4,05 pouces graisse viscérale.1
Bien que notre établissement médical n’ait pas proposé de solutions sûres, pratiques et à long terme pour lutter contre l’épidémie d’obésité d’aujourd’hui, il existe maintenant des agents naturels qui renforcent considérablement les effets d’un programme de perte de poids judicieuse.
Matériel utilisé avec la permission de Life Extension. Tous les droits sont réservés.
1. Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
2. Bunnell BA, Estes BT, Guilak F, Gimble JM. Differentiation of adipose stem cells. Methods Mol Biol. 2008;456:155-71.
3. Symonds ME, Budge H, Perkins AC, Lomax MA. Adipose tissue development – Impact of the early life environment. Prog Biophys Mol Biol. 2010 Dec 14.
4. Takakura Y, Yoshida T. Beta 3-adrenergic receptor agonists–past, present and future. Nippon Yakurigaku Zasshi. 2001 Nov;118(5):315-20.
5. Xiao L, Zhang J, Li H, Liu J, He L, Zhai Y. Inhibition of adipocyte differentiation and adipogenesis by the traditional Chinese herb Sibiraea angustata. Exp Biol Med (Maywood). 2010 Dec;235(12):1442-9.
6. Bumrungpert A, Kalpravidh RW, Chuang CC, et al. Xanthones from mangosteen inhibit inflammation in human macrophages and in human adipocytes exposed to macrophage-conditioned media. J Nutr. 2010 Apr;140 (4):842-7.
7. Amini Z, Boyd B, Doucet J, Ribnicky DM, Stephens JM. St. John’s Wort inhibits adipocyte differentiation and induces insulin resistance in adipocytes. Biochem Biophys Res Commun. 2009 Oct 9;388(1):146-9.
8. Frayn KN, Fielding BA, Karpe F. Adipose tissue fatty acid metabolism and cardiovascular disease. Curr Opin Lipidol. 2005 Aug;16(4):409-15.
9. Wang S, Soni KG, Semache M, et al. Lipolysis and the integrated physiology of lipid energy metabolism. Mol Genet Metab. 2008 Nov;95(3):117-26.
10. Lee J, Jung E, Huh S, Kim YS, Kim YW, Park D. Anti-adipogenesis by 6-thioinosine is mediated by downregulation of PPAR gamma through JNK-dependent upregulation of iNOS. Cell Mol Life Sci. 2010 Feb;67(3):467-81.
11. Smas CM, Sul HS. Molecular mechanisms of adipocyte differentiation and inhibitory action of pref-1. Crit Rev Eukaryot Gene Expr. 1997;7(4):281-98.
12. Fan B, Ikuyama S, Gu JQ, et al. Oleic acid-induced ADRP expression requires both AP-1 and PPAR response elements, and is reduced by Pycnogenol through mRNA degradation in NMuLi liver cells. Am J Physiol Endocrinol Metab. 2009 Jul;297(1):E112-23.
13. Results based on initial analyses of unpublished research data.
14. Imamura M, Inoguchi T, Ikuyama S, et al. ADRP stimulates lipid accumulation and lipid droplet formation in murine fibroblasts. Am J Physiol Endocrinol Metab. 2002 Oct;283(4):E775-83.
15. Grasselli E, Voci A, Canesi L, et al. Direct effects of iodothyronines on excess fat storage in rat hepatocytes. J Hepatol. 2010 Nov 3.
16. Imai Y, Varela GM, Jackson MB, Graham MJ, Crooke RM, Ahima RS. Reduction of hepatosteatosis and lipid levels by an adipose differentiation-related protein antisense oligonucleotide. Gastroenterology. 2007 May;132(5):1947-54.
17. Agardh HE, Folkersen L, Ekstrand J, et al. Expression of fatty acid-binding protein 4/aP2 is correlated with plaque instability in carotid atherosclerosis. J Intern Med. 2011 Feb;269(2):200-10.
18. Aragones G, Ferre R, Lazaro I, et al. Fatty acid-binding protein 4 is associated with endothelial dysfunction in patients with type 2 diabetes. Atherosclerosis. 2010 Nov;213(1):329-31.
19. Cabre A, Lazaro I, Cofan M, et al. FABP4 plasma levels are increased in familial combined hyperlipidemia. J Lipid Res. 2010 May;51(5):1173-8.
20. Cabre A, Lazaro I, Girona J, et al. Plasma fatty acid binding protein 4 is associated with atherogenic dyslipidemia in diabetes. J Lipid Res. 2008 Aug;49(8):1746-51.
21. Chmurzynska A. The multigene family of fatty acid-binding proteins (FABPs): function, structure and polymorphism. J Appl Genet. 2006;47(1):39-48.
22. Karakas SE, Almario RU, Kim K. Serum fatty acid binding protein 4, free fatty acids, and metabolic risk markers. Metabolism. 2009 Jul;58(7):1002-7.
23. Kersten S. Mechanisms of nutritional and hormonal regulation of lipogenesis. EMBO Rep. 2001 Apr;2(4):282-6.
24. Toruner F, Altinova AE, Akturk M, et al. The relationship between adipocyte fatty acid binding protein-4, retinol binding protein-4 levels and early diabetic nephropathy in patients with type 2 diabetes. Diabetes Res Clin Pract. 2010 Dec 19.
25. Tsai JP, Liou HH, Liu HM, Lee CJ, Lee RP, Hsu BG. Fasting serum fatty acid-binding protein 4 level positively correlates with metabolic syndrome in hemodialysis patients. Arch Med Res. 2010 Oct;41(7):536-40.
26. Li Y, Kang Z, Li S, Kong T, Liu X, Sun C. Ursolic acid stimulates lipolysis in primary-cultured rat adipocytes. Mol Nutr Food Res. 2010 Nov;54(11):1609-17.
27. Nerurkar PV, Lee YK, Nerurkar VR. Momordica charantia (bitter melon) inhibits primary human adipocyte differentiation by modulating adipogenic genes. BMC Complement Altern Med. 2010;10:34.
28. Tinahones FJ, Garrido-Sanchez L, Miranda M, et al. Obesity and insulin resistance-related changes in the expression of lipogenic and lipolytic genes in morbidly obese subjects. Obes Surg. 2010 Nov;20(11):1559-67.
29. Mutch NJ, Thomas L, Moore NR, Lisiak KM, Booth NA. TAFIa, PAI-1 and alpha-antiplasmin: complementary roles in regulating lysis of thrombi and plasma clots. J Thromb Haemost. 2007 Apr;5(4):812-7.
30. Trayhurn P, Wood IS. Signalling role of adipose tissue: adipokines and inflammation in obesity. Biochem Soc Trans. 2005 Nov;33(Pt 5):1078-81.
31. Gnacinska M, Malgorzewicz S, Guzek M, Lysiak-Szydłowska W, Sworczak K. Adipose tissue activity in relation to overweight or obesity. Endokrynol Pol. 2010 Mar-Apr;61(2):160-8.
32. Cock TA, Houten SM, Auwerx J. Peroxisome proliferator-activated receptor-gamma: too much of a good thing causes harm. EMBO Rep. 2004 Feb;5(2):142-7.
33. Jiang HZ, Quan XF, Tian WX, et al. Fatty acid synthase inhibitors of phenolic constituents isolated from Garcinia mangostana. Bioorg Med Chem Lett. 2010 Oct 15;20(20):6045-7.
34. Choi JH, Banks AS, Estall JL, et al. Anti-diabetic drugs inhibit obesity-linked phosphorylation of PPARgamma by Cdk5. Nature. 2010 Jul 22;466(7305):451-6.
35. Oben JE, Ngondi JL, Blum K. Inhibition of Irvingia gabonensis seed extract (OB131) on adipogenesis as mediated via down regulation of the PPARgamma and leptin genes and up-regulation of the adiponectin gene. Lipids Health Dis. 2008;7:44.
36. Tsukahara T, Hanazawa S, Murakami-Murofushi K. Cyclic phosphatidic acid influences the expression and regulation of cyclic nucleotide phosphodiesterase 3B and lipolysis in 3T3-L1 cells. Biochem Biophys Res Commun. 2011 Jan 7;404(1):109-14.
37. An S, Han JI, Kim MJ, et al. Ethanolic extracts of Brassica campestris spp. rapa roots prevent high-fat diet-induced obesity via beta(3)-adrenergic regulation of white adipocyte lipolytic activity. J Med Food. 2010 Apr;13(2):406-14.
38. Hatakeyama Y, Sakata Y, Takakura S, Manda T, Mutoh S. Acute and chronic effects of FR-149175, a beta 3-adrenergic receptor agonist, on energy expenditure in Zucker fatty rats. Am J Physiol Regul Integr Comp Physiol. 2004 Aug;287(2):R336-41.
39. Lima JJ, Feng H, Duckworth L, et al. Association analyses of adrenergic receptor polymorphisms with obesity and metabolic alterations. Metabolism. 2007 Jun;56(6):757-65.
40. Sakura H, Togashi M, Iwamoto Y. Beta 3-adrenergic receptor agonists as anti-obese and anti-diabetic drugs. Nippon Rinsho. 2002 Jan;60(1):123-9.
41. van Baak MA, Hul GB, Toubro S, et al. Acute effect of L-796568, a novel beta 3-adrenergic receptor agonist, on energy expenditure in obese men. Clin Pharmacol Ther. 2002 Apr;71(4):272-9.
42. Ukkola O, Santaniemi M. Adiponectin: a link between excess adiposity and associated comorbidities? J Mol Med. 2002 Nov;80(11):696-702.
43. Koh H, Hayashi T, Sato KK, et al. Visceral adiposity, not abdominal subcutaneous fat area, is associated with high blood pressure in Japanese men: the Ohtori study. Hypertens Res. 2011 Jan 13.
44. Lee YH, Lee SH, Jung ES, et al. Visceral adiposity and the severity of coronary artery disease in middle-aged subjects with normal waist circumference and its relation with lipocalin-2 and MCP-1. Atherosclerosis. 2010 Dec;213(2):592-7.
45. Navarro E, Mijac V, Ryder HF. Ultrasonography measurement of intrabdominal visceral fat in obese men. Association with alterations in serum lipids and insulinemia. Arch Latinoam Nutr. 2010 Jun;60(2):160-7.
46. Galani VJ, Patel BG, Rana DG. Sphaeranthus indicus Linn.: A phytopharmacological review. Int J Ayurveda Res. 2010 Oct;1(4):247-53.
47. Prabhu KS, Lobo R, Shirwaikar A. Antidiabetic properties of the alcoholic extract of Sphaeranthus indicus in streptozotocin-nicotinamide diabetic rats. J Pharm Pharmacol. 2008 Jul;60(7):909-16.
48. Ramachandran S, Asokkumar K, Uma Maheswari M, et al. Investigation of Antidiabetic, Antihyperlipidemic, and In Vivo Antioxidant Properties of Sphaeranthus indicus Linn. in Type 1 Diabetic Rats: An Identification of Possible Biomarkers. Evid Based Complement Alternat Med. 2011;2011.
49. Ghaisas M, Zope V, Takawale A, Navghare V, Tanwar M, Deshpande A. Preventive effect of Sphaeranthus indicus during progression of glucocorticoid-induced insulin resistance in mice. Pharm Biol. 2010 Dec;48(12):1371-5.
50. Shirwaikar A, Prabhu KS, Punitha IS. In vitro antioxidant studies of Sphaeranthus indicus (Linn). Indian J Exp Biol. 2006 Dec;44(12):993-6.
51. Loo AE, Huang D. Assay-guided fractionation study of alpha-amylase inhibitors from Garcinia mangostana pericarp. J Agric Food Chem. 2007 Nov 28;55(24):9805-10.
52. Bumrungpert A, Kalpravidh RW, Chitchumroonchokchai C, et al. Xanthones from mangosteen prevent lipopolysaccharide-mediated inflammation and insulin resistance in primary cultures of human adipocytes. J Nutr. 2009 Jun;139(6):1185-91.
53. Udani JK, Singh BB, Barrett ML, Singh VJ. Evaluation of Mangosteen juice blend on biomarkers of inflammation in obese subjects: a pilot, dose finding study. Nutr J. 2009;8:48.


