Probiotiques oraux Combattre la maladie des gencives
 À l'ère de la pandémie de COVID-19, les soins d'hygiène bucco-dentaire semblent être particulièrement importants. La bouche humaine regorge de bactéries qui peuvent provoquer des caries dentaires et des gingivites et parodontites plus graves. Même de bonnes habitudes d'hygiène bucco-dentaire consistant à se brosser les dents et à utiliser la soie dentaire deux fois par jour pourraient ne pas suffire à les éloigner.
À l'ère de la pandémie de COVID-19, les soins d'hygiène bucco-dentaire semblent être particulièrement importants. La bouche humaine regorge de bactéries qui peuvent provoquer des caries dentaires et des gingivites et parodontites plus graves. Même de bonnes habitudes d'hygiène bucco-dentaire consistant à se brosser les dents et à utiliser la soie dentaire deux fois par jour pourraient ne pas suffire à les éloigner.
Près d'un tiers des adultes américains ont une carie dentaire non traitée, et près de la moitié des 30 ans et plus souffrent d'une maladie parodontale (gencive) 1,2.
La maladie des gencives peut être grave. Au fur et à mesure qu'elle progresse, elle peut entraîner une perte de dents, ainsi qu'une inflammation qui accélère les processus de vieillissement dégénératif.3 La maladie des gencives peut entraîner des problèmes cardiaques, le cancer, la maladie d'Alzheimer, des troubles pulmonaires et rénaux, etc. 4-14
Les scientifiques à la recherche d'une solution aux maladies des gencives et à la carie dentaire ont découvert un moyen innovant de réduire le risque grâce à des pastilles probiotiques orales ciblées.
Le microbiome oral
La communauté naturelle des microbes vivant dans la bouche s'appelle le microbiome oral. Un microbiome sain soutient et protège les muqueuses délicates ainsi que la surface des dents elles-mêmes.
Lorsque cette communauté est perturbée et déséquilibrée - que ce soit par une mauvaise alimentation, un mode de vie, des médicaments ou des maladies - cela entraîne un état de déséquilibre microbien (appelé dysbiose) qui fait des ravages sur la réponse normale du système immunitaire.
La dysbiose entraîne de nombreux problèmes dans la bouche, y compris des caries résultant de bactéries produisant de l'acide en excès et des maladies des gencives qui contribuent à la perte des dents ainsi que des maladies inflammatoires dans tout le corps.
La nécessité de restaurer un microbiome oral sain a conduit les scientifiques à identifier deux souches de bonnes bactéries capables de lutter contre les maladies des gencives sur deux fronts. Le premier, L. plantarum L-137, stimule la fonction immunitaire orale et favorise la guérison. Le deuxième, S. salivarius M18, tue les bactéries nocives qui vivent dans la bouche, se permettant de prospérer.15-17
Cette approche à deux volets pour la prévention des maladies des gencives soutient un microbiome sain et équilibré dans la bouche, qui résiste activement à la maladie tout en favorisant la guérison.
Exploiter les réponses immunitaires naturelles
 L'un des principaux problèmes d'un microbiome oral déséquilibré est qu'il réduit les capacités naturelles de lutte immunitaire de la bouche. Cela nous rend vulnérables aux infections par des bactéries qui causent des maladies des gencives, comme Porphyromonas gingivalis.
L'un des principaux problèmes d'un microbiome oral déséquilibré est qu'il réduit les capacités naturelles de lutte immunitaire de la bouche. Cela nous rend vulnérables aux infections par des bactéries qui causent des maladies des gencives, comme Porphyromonas gingivalis.
Pour aggraver les choses, P. gingivalis diminue encore plus le système immunitaire de la bouche en régulant à la baisse l'IL-12 protectrice et en régulant positivement l'IL-6 pro-inflammatoire, créant un cercle vicieux qui rend presque impossible pour le corps de se guérir lui-même.
Afin de contrer ce cycle de promotion de la maladie, les scientifiques ont cherché un moyen de renforcer la fonction immunitaire locale. Ils ont trouvé leur réponse dans la bactérie inoffensive Lactobacillus plantarum, souche L-137.17 Lorsqu'elle est tuée par traitement thermique, cette souche de L. plantarum augmente la production de l'IL-12 protectrice.
Le traitement des patients atteints de parodontite avec cette bactérie immunostimulante aide à surmonter la fonction immunitaire altérée dans leur bouche qui se produit à la suite de P. gingivalis. Cela aide à restaurer la réponse immunitaire orale naturelle du corps, ce qui favorise la guérison des gencives malades et enflammées.
En d'autres termes, L. plantarum bouche essentiellement le «trou» du système immunitaire induit par P. gingivalis évasif et d'autres bactéries, permettant à notre corps de résister naturellement aux maladies des gencives.17
L'impact de ceci a été vu dans un essai clinique de personnes atteintes de parodontite chronique.
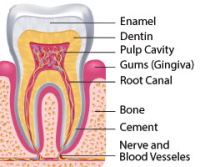 Les maladies des dents et des gencives sont souvent des facteurs majeurs négligés de détérioration de la santé à mesure que nous vieillissons.
Les maladies des dents et des gencives sont souvent des facteurs majeurs négligés de détérioration de la santé à mesure que nous vieillissons.- En plus de peser sur les fonctions de la bouche, ces conditions nous prédisposent au cœur, aux poumons, au cerveau, au foie et à d'autres troubles liés à l'âge.
- Un microbiome oral équilibré aide à maintenir un état de résistance aux maladies.
- Un microbiome déséquilibré ou dysbiotique invite au désastre en modifiant les défenses immunitaires et bactériennes naturelles élaborées contre les maladies bucco-dentaires.
- Équilibrer un microbiome oral dysbiotique peut restaurer la résistance naturelle aux maladies.
- HT-L. plantarum L-137 est une souche traitée thermiquement de bactéries Lactobacillus communes capables d'induire des cytokines pro-cicatrisantes dans la bouche et de renforcer l'immunité locale.
- S. salivarius M18 est une souche probiotique vivante armée de puissants lantibiotiques qui tuent les bactéries nocives.
- L'ajout de ces bactéries saines à une routine régulière de brossage et de soie dentaire peut aider à faire de la bouche un endroit sûr pour les microbes protecteurs, ce qui produit des bienfaits dans tout le corps.
Essai clinique
Les chercheurs ont mené un essai randomisé qui comprenait 39 personnes atteintes de parodontite chronique.17 Les sujets ont été assignés au hasard pour recevoir soit un placebo soit le supplément de L. plantarum L-137 pendant 12 semaines.
Au cours de 12 semaines, les chercheurs ont mesuré la profondeur de la poche de sondage, qui est la distance entre la ligne des gencives et le bas de la minuscule «poche» entre la gencive et la racine de la dent.17 Une poche de gomme normale et saine a une profondeur de 3 mm ou moins , et une profondeur de 4 mm ou plus définit la parodontite.21 Les poches plus profondes sont une mesure clinique de la maladie parodontale.
Après 12 semaines, les sujets recevant du L. plantarum L-137 ont connu une amélioration de 64% de la profondeur de poche par rapport aux receveurs de placebo.17
Cette remarquable étude a montré qu'il était possible d'améliorer la maladie parodontale grâce à la modulation du système immunitaire oral.
L'amélioration de la profondeur des poches est une pièce du puzzle. Il est tout aussi important de rétablir l'équilibre de la communauté microbienne de la bouche. Ce faisant, nous pouvons prévenir le dysfonctionnement immunitaire et les changements inflammatoires qui en résultent avant qu'ils ne s'installent. C'est là qu'un probiotique oral appelé S. salivarius M18 vient à la rescousse.
 La maladie parodontale (gencive) peut être douloureuse, défigurante et même invalidante en cas de perte de dents et de résorption de la mâchoire.
La maladie parodontale (gencive) peut être douloureuse, défigurante et même invalidante en cas de perte de dents et de résorption de la mâchoire.
Mais la nouvelle science montre que la maladie parodontale a des conséquences profondes qui s'étendent à la plupart des systèmes corporels, en grande partie à la suite de changements inflammatoires et d'autres perturbations des voies de signalisation dans tout le corps.
La maladie des gencives est désormais associée à des troubles du cerveau, du cœur, des poumons, des reins, du foie et des vaisseaux sanguins, qui favorisent tous le vieillissement et raccourcissent la durée de vie.7-14
La bonne nouvelle est que la réduction de la plaque chargée de bactéries entraîne une réduction significative de la inflammation totale du corps.29 Cela signifie que l'amélioration de la santé de nos dents et de nos gencives est vitale non seulement pour ces structures buccales, mais aussi pour préserver notre santé dans pratiquement tous les systèmes corporels.
Un système de défense orale probiotique bien armé
 Un microbiome oral résistant aux maladies comprend une grande variété de microbes qui assurent des fonctions biologiques importantes. Un microbiome dysbiotique est un microbiome dans lequel une ou plusieurs souches nuisibles dominent, supprimant d'autres organismes bénéfiques et créant un environnement propice aux maladies.
Un microbiome oral résistant aux maladies comprend une grande variété de microbes qui assurent des fonctions biologiques importantes. Un microbiome dysbiotique est un microbiome dans lequel une ou plusieurs souches nuisibles dominent, supprimant d'autres organismes bénéfiques et créant un environnement propice aux maladies.
Ce que la recherche prouve, c'est que pour restaurer la santé bucco-dentaire et éviter des problèmes tels que les maladies des gencives, il est nécessaire de soutenir la colonisation et la croissance des organismes utiles22.
Les organismes utiles rivalisent avec les «méchants», réduisant leurs populations à la taille et permettant à un plus large éventail de microbes bénéfiques de réussir.
S. salivarius M18 est l'un des «bons gars». Il est en concurrence avec des bactéries buccales dangereuses qui provoquent ou aggravent la maladie parodontale, et il a été démontré qu'il améliore les paramètres de la gingivite et de la parodontite.15,16
Un essai contrôlé randomisé a été mené pour déterminer l'impact du traitement par S. salivarius M18 sur certains des paramètres cliniques les plus importants de la santé buccale et gingivale (gencives) .23 L'étude a porté sur des hommes et des femmes âgés de 20 à 60 ans présentant des troubles modérés ou sévères. gingivite (score d'index gingival de 2 ou 3) et parodontite modérée (profondeur de poche de sondage inférieure à 6 mm).
La moitié des sujets n'a reçu aucun traitement et la moitié a reçu des pastilles avec 200 millions de S. salivarius M18 par jour après le brossage. Les sujets ont pris les pastilles pendant 30 jours, et les chercheurs les ont observés pendant 30 jours supplémentaires pour déterminer si les bénéfices continueraient même après que les sujets ont cessé de prendre le probiotique.
Les résultats du groupe S. salivarius M18 étaient favorables pour les quatre mesures par rapport au groupe témoin: 23
- Le score d'indice de plaque moyen a été réduit de 44% au jour 30 (le dernier jour de traitement) et de 37% au jour 60.
- Le score moyen de l'indice gingival a été réduit de 42% au jour 30 et de 35% au jour 60.
- Les scores de l'indice de saignement du sulcus modifié ont été réduits de 53% au jour 30 et de 51% au jour 60.
- Enfin, les mesures de la profondeur de la poche de sondage ont été réduites de 20% au jour 30 et de 22% au jour 60.
Il convient de noter que les scores les plus bas pour chaque indice dans le groupe S. salivarius M18 indiquent un retour à des valeurs presque normales de moins de 1 pour l'indice de plaque, l'indice gingival et l'indice de saignement du sulcus modifié, et une profondeur de poche de sondage d'un peu plus de 3 mm. Ces valeurs sont restées nettement anormales chez les sujets témoins.23
Cette étude a démontré la capacité de la pastille probiotique non seulement d'améliorer considérablement les quatre paramètres les plus importants de la santé parodontale, mais aussi de continuer à travailler longtemps après la fin de la supplémentation.
Des études cliniques antérieures apportent un soutien supplémentaire à l'utilisation de S. salivarius M18 pour la santé bucco-dentaire. Dans un cas, 88% des receveurs de S. salivarius M18 ont maintenu des scores de plaque inférieurs à leurs valeurs initiales de prétraitement à la fin d'une période de traitement de 3 mois, contre seulement 44% des receveurs du placebo.15
 La dysbiose (un microbiome déséquilibré) dans la bouche induit un dysfonctionnement profond du système immunitaire conçu pour protéger les dents et les gencives et a deux effets majeurs sur la santé bucco-dentaire:
La dysbiose (un microbiome déséquilibré) dans la bouche induit un dysfonctionnement profond du système immunitaire conçu pour protéger les dents et les gencives et a deux effets majeurs sur la santé bucco-dentaire:
- Premièrement, la dysbiose buccale et les bactéries pathogènes (par exemple, P. gingivalis) sont associées à une activité accrue des cytokines inflammatoires (molécules de signalisation), notamment l'IL-6.18
- Deuxièmement, la dysbiose réduit la production d'IL-12, une cytokine régulatrice qui soutient les réponses immunitaires saines et la guérison après l'inflammation. Cette réponse immunitaire altérée contribue à une inflammation persistante et à un ralentissement de la guérison, une situation que les microbes destructeurs peuvent exploiter pour favoriser leur propre croissance.18,30,31
La production d'IL-12 diminue avec le vieillissement, laissant un «trou» dans les réponses immunitaires dans la bouche32. Cela permet à des organismes comme P. gingivalis d'échapper au système immunitaire et de devenir envahissant, ce qui provoque finalement une maladie des gencives.30
Pour aggraver les choses, P. gingivalis lui-même altère également les réponses immunitaires de l'hôte, réduisant spécifiquement l'IL-12 bénéfique et régulant positivement l'IL-6.18-20,30, ce qui permet la prolifération de P. gingivalis et d'autres microbes producteurs d'infections et d'inflammations.33
De plus, lorsque les niveaux d'IL-6 restent élevés et les niveaux d'IL-12 bas, il est presque impossible que l'inflammation des gencives se résorbe d'elle-même. Cela conduit à un état inflammatoire chronique qui finit par éroder la cavité dentaire osseuse, entraînant finalement une perte de dents.10,18-20
Dans un processus élégant mais destructeur, P. gingivalis libère des fragments chimiques qui suppriment les effets de certaines cellules immunitaires, se «déguisant» en organisme normal et bénéfique, tout en envahissant simultanément les tissus de l'hôte et en supprimant également sa réponse immunitaire envers d'autres espèces bactériennes. .
Comment ça fonctionne
 S. salivarius M18 fonctionne par plusieurs actions pour aider à créer un environnement buccal plus sain. Contrairement à de nombreuses formulations probiotiques, S. salivarius M18 peut spécifiquement coloniser la bouche humaine. Il en résulte des colonies stables et reproductrices de cet organisme bénéfique même après la fin de la supplémentation.16
S. salivarius M18 fonctionne par plusieurs actions pour aider à créer un environnement buccal plus sain. Contrairement à de nombreuses formulations probiotiques, S. salivarius M18 peut spécifiquement coloniser la bouche humaine. Il en résulte des colonies stables et reproductrices de cet organisme bénéfique même après la fin de la supplémentation.16
Il a également été démontré que S. salivarius M18 rivalise efficacement avec les bactéries (telles que Streptococcus mutans) qui peuvent provoquer des caries, contribuant ainsi à maintenir des dents et des gencives saines15.
S. salivarius M18 est un producteur abondant d'armes anti-bactériennes appelées bactériocines.
Les bactériocines fonctionnent de manière similaire aux antibiotiques, mais sont entièrement naturelles et semblent n'agir qu'au niveau local entre différentes souches bactériennes.24
Les bactériocines spécifiques produites par S. salivarius M18 appartiennent à une classe appelée lantibiotiques qui utilisent un mode d'action qui crée littéralement un trou, ou pore, dans la membrane cellulaire de l'organisme cible menant à sa destruction.25,26 De cette façon, S. salivarius M18 s'est révélé inhiber la croissance de plusieurs organismes producteurs de maladies des dents et des gencives bien connus, notamment S. mutans, S. sobrinus et Actinomyces naeslundii.15,24,27,28
En plus de cibler les organismes pathogènes, S. salivarius M18 produit des enzymes qui aident à décomposer la plaque dentaire, qui est la principale cause de carie dentaire et de maladie des gencives. S. salivarius M18 contribue également à générer un pH neutre dans la bouche qui soutient des bactéries saines, équilibrant davantage le microbiome oral et réduisant le risque de maladie.15
Une autre découverte de recherche est que S. salivarius M18 réduit la présence de la cytokine pro-inflammatoire IL-6 qui est associée à la maladie parodontale.15 Ceci complète un chevauchement bénéfique avec les caractéristiques immunomodulatrices de L. plantarum L-137, fournissant protection supplémentaire contre l'inflammation chronique des gencives.
 Tout ce sondage et fouiner dans votre bouche chez le dentiste n'est pas amusant. Mais le dentiste ou l'hygiéniste examine en fait attentivement les multiples caractéristiques des dents et des gencives.
Tout ce sondage et fouiner dans votre bouche chez le dentiste n'est pas amusant. Mais le dentiste ou l'hygiéniste examine en fait attentivement les multiples caractéristiques des dents et des gencives.
Ceux-ci ont été standardisés en plusieurs scores utiles pour mesurer la santé des gencives, ainsi que pour déterminer la meilleure option de traitement.
Ceux utilisés dans les études citées dans cet article sont:
- Le score de l'indice de plaque: une note de zéro à 3, zéro étant sans plaque, et 3 étant une abondance de plaque qui s'étend sous la ligne des gencives sur les dents.34
- Le score de l'indice gingival: une note de zéro à 3, zéro étant des gencives normales et 3 indiquant une inflammation sévère avec gonflement, ulcération et une tendance aux saignements spontanés34.
- Le score de l'indice de saignement modifié de Sulcus: un score de 0 à 3, zéro étant sans saignement avec un sondage dentaire doux et 3 étant un saignement prêt, un changement de couleur et un gonflement des gencives.35
- Profondeur de la poche de sondage: à l'aide d'une sonde calibrée marquée en millimètres, le dentiste ou l'hygiéniste mesure la profondeur de la poche entre la racine de la dent et la gencive. Généralement, plus la poche est profonde, plus la maladie des gencives est grave, avec des poches de 3 mm ou moins de profondeur considérées comme normales, tandis que celles plus profondes que 4 mm indiquent une parodontite21,36.
Sommaire
Les maladies des gencives sont endémiques, d'autant plus que nous vieillissons depuis 30 ans.
Le brossage des dents et la soie dentaire sont importants, mais sont insuffisants pour restaurer un microbiome oral endommagé à son état naturel résistant aux maladies.
Les progrès récents dans la compréhension des bactéries bénéfiques (probiotiques) révèlent une approche à deux volets pour restaurer un microbiome équilibré et rajeunir la fonction immunitaire saine dans la bouche.
L. plantarum L-137 est une préparation traitée thermiquement de bactéries bénéfiques de L. plantarum qui stimule la fonction immunitaire orale, réduit l'inflammation et favorise la guérison.
S. salivarius M18 est un probiotique oral éprouvé capable de coloniser la bouche humaine, où il tue les bactéries nocives.
Ces deux probiotiques, lorsqu'ils sont pris comme une pastille quotidienne, peuvent travailler ensemble pour améliorer non seulement la santé buccale, mais aussi la santé totale du corps.
Matériel utilisé avec la permission de Life Extension. Tous les droits sont réservés.
-
Available at: http://www.cdc.gov/OralHealth/children_adults/adults.htm. Accessed October 25, 2016.
-
Available at: http://www.cdc.gov/oralhealth/periodontal_disease/. Accessed December 8, 2016.
-
Sampaio-Maia B, Caldas IM, Pereira ML, et al. The Oral Microbiome in Health and Its Implication in Oral and Systemic Diseases. Adv Appl Microbiol. 2016;97:171-210.
-
Saffi MA, Furtado MV, Polanczyk CA, et al. Relationship between vascular endothelium and periodontal disease in atherosclerotic lesions: Review article. World J Cardiol. 2015;7(1):26-30.
-
Yao QW, Zhou DS, Peng HJ, et al. Association of periodontal disease with oral cancer: a meta-analysis. Tumour Biol. 2014;35(7):7073-7.
-
Watts A, Crimmins EM, Gatz M. Inflammation as a potential mediator for the association between periodontal disease and Alzheimer’s disease. Neuropsychiatr Dis Treat. 2008;4(5):865-76.
-
Kamer AR, Pirraglia E, Tsui W, et al. Periodontal disease associates with higher brain amyloid load in normal elderly. Neurobiol Aging. 2015;36(2):627-33.
-
Prasanna SJ. Causal relationship between periodontitis and chronic obstructive pulmonary disease. J Indian Soc Periodontol. 2011;15(4):359-65.
-
Fisher MA, Taylor GW, West BT, et al. Bidirectional relationship between chronic kidney and periodontal disease: a study using structural equation modeling. Kidney Int. 2011;79(3):347-55.
-
Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 2015;15(1):30-44.
-
Humphrey LL, Fu R, Buckley DI, et al. Periodontal disease and coronary heart disease incidence: a systematic review and meta-analysis. J Gen Intern Med. 2008;23(12):2079-86.
-
Liu Z, Zhang W, Zhang J, et al. Oral hygiene, periodontal health and chronic obstructive pulmonary disease exacerbations. J Clin Periodontol. 2012;39(1):45-52.
-
Scannapieco FA, Bush RB, Paju S. Associations between periodontal disease and risk for nosocomial bacterial pneumonia and chronic obstructive pulmonary disease. A systematic review. Ann Periodontol. 2003;8(1):54-69.
-
Kshirsagar AV, Moss KL, Elter JR, et al. Periodontal disease is associated with renal insufficiency in the Atherosclerosis Risk In Communities (ARIC) study. Am J Kidney Dis. 2005;45(4):650-7.
-
Burton JP, Drummond BK, Chilcott CN, et al. Influence of the probiotic Streptococcus salivarius strain M18 on indices of dental health in children: a randomized double-blind, placebo-controlled trial. J Med Microbiol. 2013;62(Pt 6):875-84.
-
Burton JP, Wescombe PA, Macklaim JM, et al. Persistence of the oral probiotic Streptococcus salivarius M18 is dose dependent and megaplasmid transfer can augment their bacteriocin production and adhesion characteristics. PLoS One. 2013;8(6):e65991.
-
Iwasaki K, Maeda K, Hidaka K, et al. Daily Intake of Heat-killed Lactobacillus plantarum L-137 Decreases the Probing Depth in Patients Undergoing Supportive Periodontal Therapy. Oral Health Prev Dent. 2016;14(3):207-14.
-
Liang S, Krauss JL, Domon H, et al. The C5a receptor impairs IL-12-dependent clearance of Porphyromonas gingivalis and is required for induction of periodontal bone loss. J Immunol. 2011;186(2):869-77.
-
Johnson RB, Serio FG. Interleukin-18 concentrations and the pathogenesis of periodontal disease. J Periodontol. 2005;76(5):785-90.
-
Gemmell E, Seymour GJ. Immunoregulatory control of Th1/Th2 cytokine profiles in periodontal disease. Periodontol 2000. 2004;35:21-41.
-
Available at: http://www.merckmanuals.com/professional/dental-disorders/periodontal-disorders/periodontitis. Accessed February 1, 2017.
-
Bonifait L, Chandad F, Grenier D. Probiotics for oral health: myth or reality? J Can Dent Assoc. 2009;75(8):585-90.
-
Scariya L, Nagarathna DV, Varghese M. Probiotics in Periodontal Therapy. Int J Pharm Bio. 2015 Jan;6(1):242-50.
-
Wescombe PA, Upton M, Renault P, et al. Salivaricin 9, a new lantibiotic produced by Streptococcus salivarius. Microbiology. 2011;157(Pt 5):1290-9.
-
Bierbaum G, Sahl HG. Lantibiotics: mode of action, biosynthesis and bioengineering. Curr Pharm Biotechnol. 2009;10(1):2-18.
-
Islam MR, Nagao J, Zendo T, et al. Antimicrobial mechanism of lantibiotics. Biochem Soc Trans. 2012;40(6):1528-33.
-
Wescombe PA, Burton JP, Cadieux PA, et al. Megaplasmids encode differing combinations of lantibiotics in Streptococcus salivarius. Antonie Van Leeuwenhoek. 2006;90(3):269-80.
-
Wescombe PA, Upton M, Dierksen KP, et al. Production of the lantibiotic salivaricin A and its variants by oral streptococci and use of a specific induction assay to detect their presence in human saliva. Appl Environ Microbiol. 2006;72(2):1459-66.
-
Fasula K, Evans CA, Boyd L, et al. Randomized trial of Plaque identifying Toothpaste: Dental Plaque and Inflammation. Am J Med. 2016.
-
Hajishengallis G, Shakhatreh MA, Wang M, et al. Complement receptor 3 blockade promotes IL-12-mediated clearance of Porphyromonas gingivalis and negates its virulence in vivo. J Immunol. 2007;179(4):2359-67.
-
Li L, Hsu HC, Stockard CR, et al. IL-12 inhibits thymic involution by enhancing IL-7- and IL-2-induced thymocyte proliferation. J Immunol. 2004;172(5):2909-16.
-
Banerjee C, Ulloor J, Dillon EL, et al. Identification of serum biomarkers for aging and anabolic response. Immun Ageing. 2011;8(1):5.
-
Costalonga M, Herzberg MC. The oral microbiome and the immunobiology of periodontal disease and caries. Immunol Lett. 2014;162(2 Pt A):22-38.
-
Loe H. The Gingival Index, the Plaque Index and the Retention Index Systems. J Periodontol. 1967;38(6):Suppl:610-6.


