Perdere chili inibendo l'accumulo di grasso cellulare
 Le autorità sanitarie avvertono delle devastanti conseguenze dell'obesità, ma i medici rimangono all'oscuro di ciò che fa sì che le persone accumulino così tanti chili di grasso con l'età.
Le autorità sanitarie avvertono delle devastanti conseguenze dell'obesità, ma i medici rimangono all'oscuro di ciò che fa sì che le persone accumulino così tanti chili di grasso con l'età.
Attraverso una serie di studi ben progettati, gli scienziati che hanno studiato alcuni estratti vegetali hanno scoperto che possono bloccare l'accumulo di grasso a livello cellulare.
Con un significativo progresso scientifico, è stata identificata una nuova potente arma per aiutare a indurre in sicurezza la perdita di peso.
Questo articolo descrive come un nuovo estratto vegetale duale modula favorevolmente sei percorsi che le cellule adipose utilizzano per innescare l'aumento di peso.
Quando sono stati testati sugli esseri umani in uno studio controllato con placebo, coloro che hanno assunto questo doppio estratto vegetale hanno perso 4,05 pollici di grasso addominale e sono caduti 11,4 libbre dopo otto settimane... con una perdita di peso osservata già in 14 giorni.1
Le cellule che immagazzinano il grasso sono chiamate adipociti. Sono depositati in tutto il nostro corpo.2,3
Con l'avanzare dell'età, gli adipociti tendono ad espandersi e ad aggregarsi in aree esteticamente sgradevoli e dannose per la nostra salute.
Di maggiore preoccupazione sono gli adipociti che si depositano in profondità nei nostri addominali. Questo "grasso viscerale" rappresenta più del grasso immagazzinato sul nostro girovita. Il grasso viscerale è un tessuto chimicamente attivo che sforna un torrente di citochine pro-infiammatorie.4
Quelli con il grasso della pancia rigonfio subiscono il costante bombardamento di citochine tossiche che innescano la sindrome metabolica e le sue conseguenze mortali.5,6
Questo problema diffuso ha portato gli scienziati a cercare estratti vegetali che interferiscono specificamente con l'accumulo di grasso degli adipociti nella nostra anatomia addominale.
Come si verifica l'accumulo di grasso indesiderato
 Le calorie in eccesso si trasformano in depositi di grasso negli adipociti7 attraverso un processo in più fasi noto come adipogenesi.
Le calorie in eccesso si trasformano in depositi di grasso negli adipociti7 attraverso un processo in più fasi noto come adipogenesi.
Quando vengono consumate meno calorie, il grasso viene rilasciato dagli adipociti per soddisfare il fabbisogno energetico del corpo.8,9 Questo è noto come lipolisi.
È stato studiato un doppio estratto vegetale in base alla sua capacità di inibire contemporaneamente l'adipogenesi (accumulo di grasso) e migliorare la lipolisi (scomposizione e rilascio di grasso).
Come qualsiasi altra cellula, gli adipociti si sviluppano da cellule staminali indifferenziate. Le cellule adipose premature e in via di sviluppo sono chiamate pre-adipociti. Quando ingerisci più calorie di quelle di cui il tuo corpo ha bisogno, i pre-adipociti "giovani" rispondono maturando in adipociti "adulti".7,10-12
Gli adipociti "adulti" assorbono gli acidi grassi in eccesso dal flusso sanguigno e iniziano a espandersi. È questo processo di assorbimento degli acidi grassi e di espansione degli adipociti che alla fine si traduce nell'obesità e nelle sue conseguenze patologiche. Ogni caloria in eccesso contribuisce in questo modo alla maturazione e alla crescita delle cellule adipose. Oltre un certo punto, gli adipociti si dilatano e si gonfiano, proprio come fa la tua pancia.
Non tutti gli adipociti sono uguali. Mentre le cellule adipose si distribuiscono in tutto il corpo, quelle che immagazzinano nell'addome, producendo il cosiddetto grasso viscerale o grasso della pancia, sono più che semplici "contenitori" di stoccaggio.
Le cellule adipose della pancia sono chimicamente attive. Formano tessuto adiposo in grado di rilasciare citochine proinfiammatorie dannose.4
Negli individui obesi, la massa di depositi di grasso viscerale in eccesso genera un flusso pro-infiammatorio di citochine. Questo rilascio di citochine provoca quindi una cascata di effetti dannosi che, se non controllati, contribuiscono all'insorgenza di molteplici malattie degenerative.5,6
Quindi l'accumulo indesiderato di grasso corporeo si verifica quando le cellule staminali pre-adipocitarie maturano per immagazzinare il grasso alimentare in eccesso (adipogenesi) mentre diminuisce la capacità di scomporre il grasso immagazzinato (lipolisi).
 Un'epidemia di obesità continua a imperversare in questo paese, con oltre due terzi della popolazione americana in sovrappeso o obesa.
Un'epidemia di obesità continua a imperversare in questo paese, con oltre due terzi della popolazione americana in sovrappeso o obesa.- La medicina convenzionale non ha ancora offerto alcuna soluzione pratica, sicura e a lungo termine.
- Ricercatori all'avanguardia continuano a identificare nuovi agenti naturali che inducono la perdita di peso.
- Tra i più recenti c'è un duplice estratto vegetale contenente estratti del fiore S. indicus e del frutto del mangostano, entrambi originari dell'Asia.
- Quando combinata, la risultante miscela a doppio estratto influenza favorevolmente sei distinti percorsi biomolecolari attraverso i quali le cellule adipose innescano l'aumento di peso. In studi clinici controllati con placebo che hanno coinvolto soggetti obesi, questo doppio estratto ha indotto in modo sicuro una perdita di peso totale di 11,4 libbre, un calo di 2,05 dell'indice di massa corporea (BMI) e una riduzione di 4,05 pollici del grasso viscerale dannoso dopo appena otto settimane.1
Combattere l'accumulo di grasso corporeo in eccesso
Alla ricerca di interventi naturali che inibissero efficacemente l'accumulo di grasso (adipogenesi) e migliorassero la combustione dei grassi (lipolisi), gli scienziati hanno valutato più di mille piante per prove che soddisfacessero questi criteri.13
Due piante i cui estratti hanno dimostrato effetti biologici significativi erano:
- Sphaeranthus indicus fiore (S. indicus)13
- Frutto di mangostano (Garcinia mangostana).13
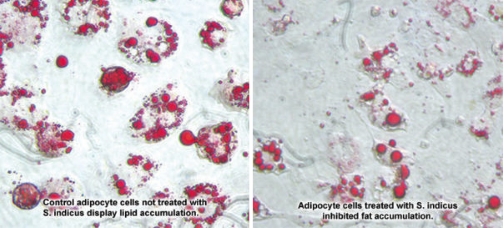
In laboratorio, estratti di S. indicus e mangostano hanno fortemente ostacolato l'adipogenesi.
Quando le cellule sono state trattate con S. indicus da solo, l'accumulo di grasso è stato inibito fino al 65%, rispetto alle cellule di controllo. Le fotografie (sotto) mostrano una differenza notevolmente visibile tra i due gruppi di cellule. Le cellule di controllo mostrano un aspetto gonfio, "schiumoso", rigonfio di goccioline di grasso, rispetto alle cellule più piccole e dai contorni più naturali trattate con l'estratto di S. indicus.13
 Ciascuno di questi estratti ha anche migliorato la lipolisi (o combustione dei grassi), fino al 56% rispetto alle cellule di controllo.13
Ciascuno di questi estratti ha anche migliorato la lipolisi (o combustione dei grassi), fino al 56% rispetto alle cellule di controllo.13
Dopo aver identificato queste proprietà unificanti nei due estratti, i ricercatori hanno deciso di determinare se avrebbero mostrato effetti potenziati se usati in combinazione.
Hanno scoperto che gli estratti di S. indicus e mangostano modulano favorevolmente l'attività di sei vie genomiche coinvolte nella formazione e rottura delle cellule adipose.13
Sorprendentemente, questi estratti hanno ridotto l'espressione genica che promuove l'adipogenesi mentre influenza favorevolmente un gene coinvolto nella lipolisi desiderabile.
Il riquadro in questa pagina mostra come questi estratti vegetali, usati da soli e in combinazione, abbiano modulato positivamente i marcatori coinvolti nell'accumulo di grasso cellulare indesiderato inibendo l'adipogenesi e favorendo la lipolisi.
Alla luce di queste osservazioni, i ricercatori hanno riconosciuto che questa nuova miscela di estratti vegetali potrebbe comportare una significativa perdita di peso attraverso tre distinti meccanismi:
- Impedire alle cellule adipose “giovani” (pre-adipociti) di trasformarsi in cellule adipose “mature” (adipociti);
- Riducendo la quantità di acidi grassi che gli adipociti potrebbero assorbire;
- Accelerare la rottura delle riserve di grasso esistenti degli adipociti gonfi.
Il passo successivo è stato determinare se questi estratti vegetali avrebbero indotto la perdita di peso negli animali da esperimento e, soprattutto, negli esseri umani obesi.
Prevenire l'obesità nei roditori
Quando i giovani ratti adulti vengono nutriti con una dieta ricca di grassi, aumentano rapidamente di peso, proprio come fanno spesso gli umani.
 Per studiare gli effetti degli estratti vegetali che hanno funzionato negli studi sulle cellule, gli scienziati hanno nutrito un gruppo di giovani ratti adulti con una dieta ricca di grassi. Metà dei ratti ha ricevuto il doppio estratto vegetale mentre l'altra metà è servita come gruppo di controllo.13
Per studiare gli effetti degli estratti vegetali che hanno funzionato negli studi sulle cellule, gli scienziati hanno nutrito un gruppo di giovani ratti adulti con una dieta ricca di grassi. Metà dei ratti ha ricevuto il doppio estratto vegetale mentre l'altra metà è servita come gruppo di controllo.13
Alla fine di otto settimane, il gruppo di controllo ha rapidamente guadagnato peso. I ratti hanno nutrito una dieta ricca di grassi e dato il doppio estratto vegetale, d'altra parte, hanno ridotto l'aumento di peso corporeo di un impressionante 700%.13
Ciò non sorprende considerando che questi stessi estratti vegetali hanno bloccato l'accumulo di grasso del 48,5% e del 65,9% nel modello cellulare.13
Questo studio ha dimostrato che questi estratti vegetali riducono l'obesità indotta dalla dieta nei giovani ratti adulti. La vera sfida, tuttavia, è se questi stessi estratti vegetali siano efficaci negli esseri umani che sono già obesi.
Come questi estratti vegetali combattono il sovraccarico di adipociti
La nuova miscela di estratti di S. indicus e mangostano inibisce l'espansione di nuove cellule adipose promuovendo la disgregazione dei lipidi negli adipociti esistenti. Studi di laboratorio dimostrano i seguenti meccanismi molecolari che consentono a queste due piante di combattere il sovraccarico di adipociti:
- Proteina correlata alla differenziazione degli adipociti (ADRP): stimola l'accumulo di lipidi e la formazione di goccioline lipidiche nelle cellule adipose.13,14 La riduzione dei livelli di ADRP è considerata una nuova strategia per prevenire o ridurre l'accumulo di grasso pericoloso, specialmente nel fegato.12,13,15 ,16
- Proteina 4 legante gli acidi grassi degli adipociti: nota anche come aP2, trasporta gli acidi grassi nelle cellule adipose per la conservazione. Livelli aumentati di aP2 sono associati ad anomalie del profilo lipidico che portano all'aterosclerosi; possono anche essere un fattore di rischio indipendente per la sindrome metabolica e le malattie cardiovascolari.8,11,17-25
- Perilipina: una proteina che ricopre le goccioline lipidiche negli adipociti, proteggendo così il loro contenuto di grasso dalla scomposizione. L'inibizione della perilipina favorisce quindi la lipolisi, contribuendo alla riduzione del contenuto di grasso degli adipociti.9,26-28
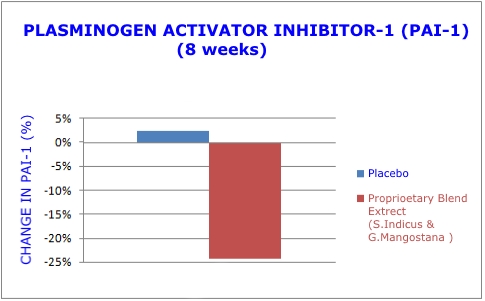
- Inibitore dell'attivatore del plasminogeno-1 (PAI-1): prodotto principalmente dalle cellule endoteliali (che rivestono le arterie), il PAI-1 svolge un ruolo chiave nella formazione e rottura del coagulo sanguigno.29 È anche secreto dal tessuto adiposo.30 Alti livelli di PAI -1 quindi correla direttamente con l'obesità addominale, il peso corporeo e l'indice di massa corporea o BMI.31 In presenza di questa nuova miscela di estratti vegetali, i livelli di PAI-1 sono risultati in definitiva diminuiti in modo significativo.1
- PPAR-gamma (peroxisome proliferator-activated receptor-gamma): un "sensore" metabolico primario che innesca l'adipogenesi in presenza di calorie in eccesso.32 La riduzione dell'attività del PPAR-gamma aiuta a prevenire il gonfiore e la disfunzione delle cellule adipose. 7,9,14,33-36
- Recettore beta-3-adrenergico (3AR): l'espressione genica per questo recettore scoperto di recente è stata aumentata dal doppio estratto vegetale. Regola la disgregazione dei grassi (lipolisi) quando è necessaria una sferzata di energia. L'attivazione del recettore beta-3 in modo spontaneo e drammatico aumenta il dispendio energetico delle cellule adipose, bruciando il grasso inutilizzato nel processo.6,37-41
I ricercatori hanno dimostrato che le sei vie genomiche coinvolte nella formazione e scomposizione delle cellule adipose (descritte sopra) sono modulate favorevolmente se esposte a S. indicus e estratti di mangostano.17 Ciò fornisce una base scientifica per spiegare gli effetti anti-obesità osservati negli studi clinici sull'uomo.
Risultati di perdita di peso negli esseri umani
Gli studi sulla perdita di peso umano comprendono un braccio attivo che ha ricevuto l'agente per la riduzione del grasso potenzialmente efficace e un gruppo simile che ha ricevuto un placebo inattivo.
Per valutare gli effetti di questi due estratti vegetali, sono stati reclutati 60 adulti obesi e divisi in due gruppi. Un braccio di 30 pazienti ha funzionato come gruppo placebo mentre un secondo gruppo di 30 pazienti ha ricevuto 800 mg al giorno di una combinazione dei due estratti vegetali. Entrambi i gruppi hanno seguito una dieta da 2.000 calorie al giorno ed è stato chiesto di camminare per 30 minuti cinque giorni alla settimana.
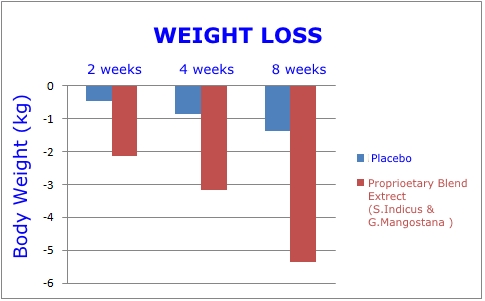
Al termine di otto settimane, il gruppo che ha ricevuto i due estratti vegetali ha mostrato i seguenti miglioramenti:1
- Riduzione del peso corporeo totale di 11,4 libbre. Questo era 3,7 volte maggiore rispetto al gruppo placebo.
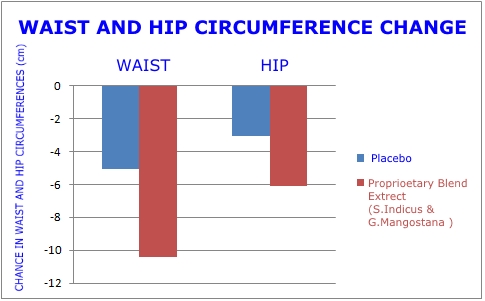
- Riduzione di 4,05 pollici nell'addome. Questo era 2 volte maggiore rispetto al gruppo placebo.
- Riduzione dell'indice di massa corporea (BMI) di 2,05. Una diminuzione 3,9 volte maggiore rispetto al gruppo placebo.
Si trattava di uno studio randomizzato, in doppio cieco, controllato con placebo, del tipo imposto dalla FDA prima di approvare nuovi farmaci. I grafici in questa pagina rivelano l'entità della perdita di peso e della riduzione del grasso della pancia che si è verificata nel gruppo che ha ricevuto il doppio estratto vegetale rispetto al placebo.1
 Oltre ai risultati favorevoli osservati a otto settimane, i ricercatori sono rimasti colpiti dalla riduzione della circonferenza della vita e dell'anca, nonché dalla perdita di peso corporeo che si è verificata nei primi 14 giorni! Infatti, dopo solo due settimane, la riduzione di peso media è stata di 4,6 libbre.1
Oltre ai risultati favorevoli osservati a otto settimane, i ricercatori sono rimasti colpiti dalla riduzione della circonferenza della vita e dell'anca, nonché dalla perdita di peso corporeo che si è verificata nei primi 14 giorni! Infatti, dopo solo due settimane, la riduzione di peso media è stata di 4,6 libbre.1
A otto settimane, il gruppo con doppio estratto vegetale ha mostrato una riduzione del rapporto vita-fianchi che era 2,2 volte maggiore rispetto al gruppo placebo. Questo è un miglioramento importante in quanto indica che si sta perdendo grasso addominale viscerale pericoloso.
Questi risultati sono supportati da un secondo studio progettato in modo simile che ha coinvolto 60 soggetti obesi. Sono stati divisi in tre gruppi che consistevano in un braccio placebo, un braccio attivo che riceveva un estratto vegetale e un altro braccio attivo che riceveva un doppio estratto vegetale. Tutti i partecipanti hanno seguito una dieta da 2.000 calorie al giorno ed è stato chiesto di camminare per 30 minuti cinque volte a settimana per 8 settimane.13
Dopo otto settimane il gruppo che ha ricevuto l'estratto vegetale doppio ha sperimentato cambiamenti statisticamente significativi nella circonferenza addominale, nel peso corporeo totale e nella circonferenza dell'anca simili a quelli osservati nel primo studio sopra menzionato.13
Questi risultati di conferma indicano che questo nuovo estratto vegetale duale può consentire agli esseri umani che invecchiano di eliminare in modo sicuro le riserve di grasso corporeo indesiderate. In nessuno dei due studi sono stati riportati eventi avversi importanti o effetti collaterali.
Protezione contro la trombosi coronarica
 La maggior parte degli attacchi cardiaci di morte improvvisa si verificano quando un coagulo di sangue si forma in un'arteria coronaria, soffocando il sangue ossigenato in una parte del muscolo cardiaco.
La maggior parte degli attacchi cardiaci di morte improvvisa si verificano quando un coagulo di sangue si forma in un'arteria coronaria, soffocando il sangue ossigenato in una parte del muscolo cardiaco.
Una proteina chiamata inibitore dell'attivatore del plasminogeno-1 (PAI-1) inibisce la normale rottura dei coaguli di sangue arterioso.29 Livelli elevati di PAI-1 si osservano negli individui obesi e sono associati ad un aumento del rischio di infarto.30,31
Durante lo studio del doppio estratto vegetale, i ricercatori hanno misurato i livelli sierici dell'inibitore dell'attivatore del plasminogeno-1 (PAI-1). Coloro che hanno ricevuto il doppio estratto vegetale hanno mostrato una riduzione del 24,3% dei livelli pericolosi di PAI-1, mentre il gruppo placebo ha mostrato un aumento del 2,4%.1 (Vedi grafico 3)
Quelli integrati con il doppio estratto vegetale hanno avuto un calo del 60% dei livelli di trigliceridi rispetto al basale.1
I soggetti a cui è stato somministrato il doppio estratto vegetale hanno aumentato i livelli dell'ormone metabolico chiave adiponectina.1 L'adiponectina regola la quantità di zucchero nel flusso sanguigno e la velocità con cui il corpo scompone il grasso. In termini di perdita di grasso, sono desiderabili livelli elevati di adiponectina. Livelli più elevati di adiponectina sono associati a una diminuzione dei depositi di grasso corporeo e a una ridotta suscettibilità al diabete e alla sindrome metabolica.42
Il gruppo del doppio estratto vegetale ha mostrato tendenze verso la riduzione di glucosio e colesterolo, che dovrebbero verificarsi in risposta alla perdita di grasso della pancia e peso corporeo.1
La perdita di grasso viscerale nel gruppo a doppio estratto - 4,05 pollici, pari al doppio del calo osservato nel gruppo placebo - è avvincente.1 Questo è importante perché il grasso viscerale rilascia una tempesta di molecole di segnalazione cellulare pro-infiammatorie. L'eccesso di grasso viscerale è un noto fattore di rischio per una serie di gravi minacce per la salute, che vanno dall'infiammazione sistemica all'aumento del rischio di ipertensione, aterosclerosi, diabete di tipo 2 e malattia coronarica.43-45
Presi insieme, questi risultati indicano un rischio di malattie vascolari notevolmente ridotto negli individui obesi che assumono 800 mg al giorno di questo doppio estratto vegetale.
Potenti proprietà antidiabetiche
 A lungo apprezzati nella medicina ayurvedica tradizionale per le loro proprietà di induzione della perdita di peso, gli scienziati hanno confermato che gli estratti di Sphaeranthus indicus (S. indicus) e il frutto del mangostano (Garcinia mangostana) esercitano un effetto antidiabetico nell'uomo.
A lungo apprezzati nella medicina ayurvedica tradizionale per le loro proprietà di induzione della perdita di peso, gli scienziati hanno confermato che gli estratti di Sphaeranthus indicus (S. indicus) e il frutto del mangostano (Garcinia mangostana) esercitano un effetto antidiabetico nell'uomo.
S. indicus è stato usato per secoli per combattere i sintomi del diabete, proteggere il fegato, sedare l'infiammazione, migliorare l'umore e favorire la digestione.46
Gli animali da laboratorio diabetici trattati con estratti di S. indicus mostrano sostanziali riduzioni della glicemia, insieme a una migliore funzionalità epatica e pancreatica.47,48 Nei topi insulino-resistenti, S. indicus estrae livelli più bassi di zucchero nel sangue e trigliceridi mentre facilita un assorbimento più efficiente del glucosio nel tessuto muscolare.49 Gli animali diabetici trattati con S. indicus mostrano livelli significativamente più bassi di ossidazione dei tessuti,50 uno dei principali fattori alla base della maggior parte delle complicanze diabetiche pericolose per la vita.48,49
Il mangostano è un frutto commestibile che cresce in tutta l'Asia meridionale. Come S. indicus, parti del frutto e del suo succo sono stati usati per secoli per combattere il diabete e l'obesità. Un meccanismo fondamentale è la sua capacità di bloccare l'enzima metabolico critico alfa-amilasi che scompone gli amidi in zucchero.51 I bloccanti dell'alfa-amilasi limitano il picco dei livelli di glucosio nel sangue che normalmente seguirebbe un pasto ricco di carboidrati. Gli estratti di mangostano inibiscono anche gli enzimi coinvolti nella sintesi delle molecole di grasso.33 È questa combinazione di blocco dell'assorbimento di zucchero e blocco della produzione di grasso che spiega in parte le sue proprietà di induzione della perdita di peso.
Gli estratti di mangostano hanno un ulteriore, notevole vantaggio. È stato dimostrato che limitano efficacemente l'infiammazione che tipicamente accompagna l'accumulo di cellule adipose.6,52 Questa infiammazione contribuisce direttamente all'insulino-resistenza. In uno studio convincente, i livelli della proteina C-reattiva del marker infiammatorio sono diminuiti significativamente53 negli individui obesi che consumavano succo di mangostano dopo sole 8 settimane.
Riepilogo
L'obesità deriva dall'aumento delle dimensioni dei singoli adipociti (cellule adipose) a causa dell'aumento dell'accumulo di lipidi (grassi). Peggiora quando un numero maggiore di pre-adipociti si trasforma in adipociti disfunzionali e gonfi.
La nuova miscela di estratti vegetali descritta in questo articolo influenza favorevolmente sei distinti percorsi attraverso i quali le cellule adipose attivano l'aumento di peso.
Nella coltura cellulare, questi estratti vegetali riducono la capacità delle cellule adipose progenitrici (pre-adipociti) di trasformarsi in cellule adipose gonfie. Questi studi mostrano anche che i componenti di questo duplice estratto vegetale riducono la quantità di acidi grassi assorbiti dagli adipociti (adipogenesi) e facilitano la scomposizione (lipolisi) del grasso immagazzinato negli adipociti esistenti.
In uno studio clinico controllato con placebo che ha coinvolto esseri umani obesi, questa miscela di estratti di piante di S. indicus e mangostano ha indotto in modo sicuro una perdita di peso di 11,4 libbre, insieme a un calo di 2,05 dell'indice di massa corporea (BMI) e una riduzione di 4,05 pollici di nocivi grasso viscerale.1
Sebbene la nostra istituzione medica non sia riuscita a offrire alcuna soluzione pratica, sicura e a lungo termine per l'odierna epidemia di obesità, sono ora disponibili agenti naturali che aumentano sostanzialmente gli effetti di un programma di perdita di peso ragionevole.
Materiale utilizzato con il permesso di Life Extension. Tutti i diritti riservati.
1. Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
2. Bunnell BA, Estes BT, Guilak F, Gimble JM. Differentiation of adipose stem cells. Methods Mol Biol. 2008;456:155-71.
3. Symonds ME, Budge H, Perkins AC, Lomax MA. Adipose tissue development – Impact of the early life environment. Prog Biophys Mol Biol. 2010 Dec 14.
4. Takakura Y, Yoshida T. Beta 3-adrenergic receptor agonists–past, present and future. Nippon Yakurigaku Zasshi. 2001 Nov;118(5):315-20.
5. Xiao L, Zhang J, Li H, Liu J, He L, Zhai Y. Inhibition of adipocyte differentiation and adipogenesis by the traditional Chinese herb Sibiraea angustata. Exp Biol Med (Maywood). 2010 Dec;235(12):1442-9.
6. Bumrungpert A, Kalpravidh RW, Chuang CC, et al. Xanthones from mangosteen inhibit inflammation in human macrophages and in human adipocytes exposed to macrophage-conditioned media. J Nutr. 2010 Apr;140 (4):842-7.
7. Amini Z, Boyd B, Doucet J, Ribnicky DM, Stephens JM. St. John’s Wort inhibits adipocyte differentiation and induces insulin resistance in adipocytes. Biochem Biophys Res Commun. 2009 Oct 9;388(1):146-9.
8. Frayn KN, Fielding BA, Karpe F. Adipose tissue fatty acid metabolism and cardiovascular disease. Curr Opin Lipidol. 2005 Aug;16(4):409-15.
9. Wang S, Soni KG, Semache M, et al. Lipolysis and the integrated physiology of lipid energy metabolism. Mol Genet Metab. 2008 Nov;95(3):117-26.
10. Lee J, Jung E, Huh S, Kim YS, Kim YW, Park D. Anti-adipogenesis by 6-thioinosine is mediated by downregulation of PPAR gamma through JNK-dependent upregulation of iNOS. Cell Mol Life Sci. 2010 Feb;67(3):467-81.
11. Smas CM, Sul HS. Molecular mechanisms of adipocyte differentiation and inhibitory action of pref-1. Crit Rev Eukaryot Gene Expr. 1997;7(4):281-98.
12. Fan B, Ikuyama S, Gu JQ, et al. Oleic acid-induced ADRP expression requires both AP-1 and PPAR response elements, and is reduced by Pycnogenol through mRNA degradation in NMuLi liver cells. Am J Physiol Endocrinol Metab. 2009 Jul;297(1):E112-23.
13. Results based on initial analyses of unpublished research data.
14. Imamura M, Inoguchi T, Ikuyama S, et al. ADRP stimulates lipid accumulation and lipid droplet formation in murine fibroblasts. Am J Physiol Endocrinol Metab. 2002 Oct;283(4):E775-83.
15. Grasselli E, Voci A, Canesi L, et al. Direct effects of iodothyronines on excess fat storage in rat hepatocytes. J Hepatol. 2010 Nov 3.
16. Imai Y, Varela GM, Jackson MB, Graham MJ, Crooke RM, Ahima RS. Reduction of hepatosteatosis and lipid levels by an adipose differentiation-related protein antisense oligonucleotide. Gastroenterology. 2007 May;132(5):1947-54.
17. Agardh HE, Folkersen L, Ekstrand J, et al. Expression of fatty acid-binding protein 4/aP2 is correlated with plaque instability in carotid atherosclerosis. J Intern Med. 2011 Feb;269(2):200-10.
18. Aragones G, Ferre R, Lazaro I, et al. Fatty acid-binding protein 4 is associated with endothelial dysfunction in patients with type 2 diabetes. Atherosclerosis. 2010 Nov;213(1):329-31.
19. Cabre A, Lazaro I, Cofan M, et al. FABP4 plasma levels are increased in familial combined hyperlipidemia. J Lipid Res. 2010 May;51(5):1173-8.
20. Cabre A, Lazaro I, Girona J, et al. Plasma fatty acid binding protein 4 is associated with atherogenic dyslipidemia in diabetes. J Lipid Res. 2008 Aug;49(8):1746-51.
21. Chmurzynska A. The multigene family of fatty acid-binding proteins (FABPs): function, structure and polymorphism. J Appl Genet. 2006;47(1):39-48.
22. Karakas SE, Almario RU, Kim K. Serum fatty acid binding protein 4, free fatty acids, and metabolic risk markers. Metabolism. 2009 Jul;58(7):1002-7.
23. Kersten S. Mechanisms of nutritional and hormonal regulation of lipogenesis. EMBO Rep. 2001 Apr;2(4):282-6.
24. Toruner F, Altinova AE, Akturk M, et al. The relationship between adipocyte fatty acid binding protein-4, retinol binding protein-4 levels and early diabetic nephropathy in patients with type 2 diabetes. Diabetes Res Clin Pract. 2010 Dec 19.
25. Tsai JP, Liou HH, Liu HM, Lee CJ, Lee RP, Hsu BG. Fasting serum fatty acid-binding protein 4 level positively correlates with metabolic syndrome in hemodialysis patients. Arch Med Res. 2010 Oct;41(7):536-40.
26. Li Y, Kang Z, Li S, Kong T, Liu X, Sun C. Ursolic acid stimulates lipolysis in primary-cultured rat adipocytes. Mol Nutr Food Res. 2010 Nov;54(11):1609-17.
27. Nerurkar PV, Lee YK, Nerurkar VR. Momordica charantia (bitter melon) inhibits primary human adipocyte differentiation by modulating adipogenic genes. BMC Complement Altern Med. 2010;10:34.
28. Tinahones FJ, Garrido-Sanchez L, Miranda M, et al. Obesity and insulin resistance-related changes in the expression of lipogenic and lipolytic genes in morbidly obese subjects. Obes Surg. 2010 Nov;20(11):1559-67.
29. Mutch NJ, Thomas L, Moore NR, Lisiak KM, Booth NA. TAFIa, PAI-1 and alpha-antiplasmin: complementary roles in regulating lysis of thrombi and plasma clots. J Thromb Haemost. 2007 Apr;5(4):812-7.
30. Trayhurn P, Wood IS. Signalling role of adipose tissue: adipokines and inflammation in obesity. Biochem Soc Trans. 2005 Nov;33(Pt 5):1078-81.
31. Gnacinska M, Malgorzewicz S, Guzek M, Lysiak-Szydłowska W, Sworczak K. Adipose tissue activity in relation to overweight or obesity. Endokrynol Pol. 2010 Mar-Apr;61(2):160-8.
32. Cock TA, Houten SM, Auwerx J. Peroxisome proliferator-activated receptor-gamma: too much of a good thing causes harm. EMBO Rep. 2004 Feb;5(2):142-7.
33. Jiang HZ, Quan XF, Tian WX, et al. Fatty acid synthase inhibitors of phenolic constituents isolated from Garcinia mangostana. Bioorg Med Chem Lett. 2010 Oct 15;20(20):6045-7.
34. Choi JH, Banks AS, Estall JL, et al. Anti-diabetic drugs inhibit obesity-linked phosphorylation of PPARgamma by Cdk5. Nature. 2010 Jul 22;466(7305):451-6.
35. Oben JE, Ngondi JL, Blum K. Inhibition of Irvingia gabonensis seed extract (OB131) on adipogenesis as mediated via down regulation of the PPARgamma and leptin genes and up-regulation of the adiponectin gene. Lipids Health Dis. 2008;7:44.
36. Tsukahara T, Hanazawa S, Murakami-Murofushi K. Cyclic phosphatidic acid influences the expression and regulation of cyclic nucleotide phosphodiesterase 3B and lipolysis in 3T3-L1 cells. Biochem Biophys Res Commun. 2011 Jan 7;404(1):109-14.
37. An S, Han JI, Kim MJ, et al. Ethanolic extracts of Brassica campestris spp. rapa roots prevent high-fat diet-induced obesity via beta(3)-adrenergic regulation of white adipocyte lipolytic activity. J Med Food. 2010 Apr;13(2):406-14.
38. Hatakeyama Y, Sakata Y, Takakura S, Manda T, Mutoh S. Acute and chronic effects of FR-149175, a beta 3-adrenergic receptor agonist, on energy expenditure in Zucker fatty rats. Am J Physiol Regul Integr Comp Physiol. 2004 Aug;287(2):R336-41.
39. Lima JJ, Feng H, Duckworth L, et al. Association analyses of adrenergic receptor polymorphisms with obesity and metabolic alterations. Metabolism. 2007 Jun;56(6):757-65.
40. Sakura H, Togashi M, Iwamoto Y. Beta 3-adrenergic receptor agonists as anti-obese and anti-diabetic drugs. Nippon Rinsho. 2002 Jan;60(1):123-9.
41. van Baak MA, Hul GB, Toubro S, et al. Acute effect of L-796568, a novel beta 3-adrenergic receptor agonist, on energy expenditure in obese men. Clin Pharmacol Ther. 2002 Apr;71(4):272-9.
42. Ukkola O, Santaniemi M. Adiponectin: a link between excess adiposity and associated comorbidities? J Mol Med. 2002 Nov;80(11):696-702.
43. Koh H, Hayashi T, Sato KK, et al. Visceral adiposity, not abdominal subcutaneous fat area, is associated with high blood pressure in Japanese men: the Ohtori study. Hypertens Res. 2011 Jan 13.
44. Lee YH, Lee SH, Jung ES, et al. Visceral adiposity and the severity of coronary artery disease in middle-aged subjects with normal waist circumference and its relation with lipocalin-2 and MCP-1. Atherosclerosis. 2010 Dec;213(2):592-7.
45. Navarro E, Mijac V, Ryder HF. Ultrasonography measurement of intrabdominal visceral fat in obese men. Association with alterations in serum lipids and insulinemia. Arch Latinoam Nutr. 2010 Jun;60(2):160-7.
46. Galani VJ, Patel BG, Rana DG. Sphaeranthus indicus Linn.: A phytopharmacological review. Int J Ayurveda Res. 2010 Oct;1(4):247-53.
47. Prabhu KS, Lobo R, Shirwaikar A. Antidiabetic properties of the alcoholic extract of Sphaeranthus indicus in streptozotocin-nicotinamide diabetic rats. J Pharm Pharmacol. 2008 Jul;60(7):909-16.
48. Ramachandran S, Asokkumar K, Uma Maheswari M, et al. Investigation of Antidiabetic, Antihyperlipidemic, and In Vivo Antioxidant Properties of Sphaeranthus indicus Linn. in Type 1 Diabetic Rats: An Identification of Possible Biomarkers. Evid Based Complement Alternat Med. 2011;2011.
49. Ghaisas M, Zope V, Takawale A, Navghare V, Tanwar M, Deshpande A. Preventive effect of Sphaeranthus indicus during progression of glucocorticoid-induced insulin resistance in mice. Pharm Biol. 2010 Dec;48(12):1371-5.
50. Shirwaikar A, Prabhu KS, Punitha IS. In vitro antioxidant studies of Sphaeranthus indicus (Linn). Indian J Exp Biol. 2006 Dec;44(12):993-6.
51. Loo AE, Huang D. Assay-guided fractionation study of alpha-amylase inhibitors from Garcinia mangostana pericarp. J Agric Food Chem. 2007 Nov 28;55(24):9805-10.
52. Bumrungpert A, Kalpravidh RW, Chitchumroonchokchai C, et al. Xanthones from mangosteen prevent lipopolysaccharide-mediated inflammation and insulin resistance in primary cultures of human adipocytes. J Nutr. 2009 Jun;139(6):1185-91.
53. Udani JK, Singh BB, Barrett ML, Singh VJ. Evaluation of Mangosteen juice blend on biomarkers of inflammation in obese subjects: a pilot, dose finding study. Nutr J. 2009;8:48.


