Otyłość brzuszna. Utrata wagi dzięki hamowaniu magazynowania tłuszczu w komórkach
 Medycyna nieustannie ostrzega nas o druzgocących konsekwencjach otyłości, jednak lekarze nadal nie wiedzą, co jest powodem związanego z wiekiem przybierania na wadze.
Medycyna nieustannie ostrzega nas o druzgocących konsekwencjach otyłości, jednak lekarze nadal nie wiedzą, co jest powodem związanego z wiekiem przybierania na wadze.
Przeprowadzając szereg badań nad pewnymi wyciągami roślinnymi naukowcy odkryli, że mogą one zahamować gromadzenie tłuszczu na poziomie komórkowym.
Dzięki znacznemu naukowemu postępowi, zidentyfikowano nową, potężną broń, bezpiecznie pomagającą stracić na wadze i wesprzeć odchudzanie.
Ten artykuł opisuje sposób w jaki nowatorski podwójny wyciąg roślinny korzystnie moduluje sześć ścieżek, poprzez które komórki tłuszczowe przyczyniają się do przyrostu wagi.
W badaniu przeprowadzonym na ludziach i kontrolowanym za pomocą grupy placebo, badani stosujący podwójny ekstrakt roślinny stracili w obwodzie 10,29 cm tłuszczu brzusznego i schudli o 5,17 kg po ośmiu tygodniach (utrata wagi zaobserwowana już po 14 dniach).[1]
Komórki, które magazynują tłuszcz, zwane są adipocytami. Znajdują się one w całym organizmie.[2]
Wraz z wiekiem, adipocyty mają skłonność do powiększania się i gromadzenia w obszarach, które kosmetycznie szpecą i są szkodliwe do naszego zdrowia. Największym zainteresowaniem cieszą się te, które magazynują się głęboko w naszych brzuchach. Ten “trzewny tłuszcz” (otyłość brzuszna) to coś więcej niż nagromadzenie tłuszczu wokół naszej talii. Jest on chemicznie aktywną tkanką, która produkuje wiele prozapalnych cytokin.[3]
Osoby z tłuszczem brzusznym stałe cierpią na wpływ toksycznych cytokin, które wywołają zespół metaboliczny i jego śmiertelne konsekwencje.[4] Ten powszechny problem doprowadził naukowców do znalezienia wyciągów roślinnych, które w sposób szczególny zapobiegają gromadzeniu się tłuszczowych adipocytów w naszej brzusznej anatomii.
Otyłość brzuszna - jak gromadzony jest zbędny tłuszcz
 Dodatkowe kalorie przekształcają się w tłuszcz zgromadzony w adipocytach [5] poprzez wielostopniowy proces znany jako adipogeneza.
Dodatkowe kalorie przekształcają się w tłuszcz zgromadzony w adipocytach [5] poprzez wielostopniowy proces znany jako adipogeneza.
Kiedy spożywamy mniej kalorii, tłuszcz uwalniany jest z adipocytów, by zaspokoić potrzeby energetyczne organizmu.[6] Proces ten znany jest jako lipoliza.
Podwójny wyciąg roślinny został zbadany pod kątem jego zdolności do równoczesnego hamowania adipogenezy (gromadzenia tłuszczów) i zwiększania lipolizy (rozkład i uwalnianie tłuszczów).
Tak jak inne komórki, adipocyty rozwija się z niezróżnicowanych komórek macierzystych. Niedojrzałe, rozwijające się komórki tłuszczowe noszą nazwę preadipocytów. Kiedy spożywamy więcej kalorii, niż ciało potrzebuje, “młode” preadipocyty dojrzewają do “dorosłych” adipocytów.[7]
„Dorosłe” adipocyty pochłaniają dodatkowe kwasy tłuszczowe z krwiobiegu i zaczynają się rozrastać. Ten proces absorpcji kwasów tłuszczowych i ekspansji adipocytów, doprowadza ostatecznie do otyłości i jej patologicznych konsekwencji. Każda dodatkowa kaloria przyczynia się do dojrzewania i wzrostu komórek tłuszczowych. W pewnym momencie, adipocyty powiększają się i stają się napęczniałe, przypominając nasze brzuchy.
Nie wszystkie adipocyty są takie same. Magazynowane w brzuchu komórki tłuszczowe — produkujące tak zwany trzewny tłuszcz lub tłuszcz brzuszny — są czymś więcej niż tylko przechowującymi go “pojemnikami”.
Komórki tłuszczowe w okolicy brzucha są chemicznie aktywne. Tworzą tkankę tłuszczową zdolną do uwalniania szkodliwych prozapalnych cytokin.[8]
U otyłych osób, mnóstwo dodatkowego depozytu tłuszczu trzewnego generuje prozapalną „powódź” cytokin. To uwalnianie cytokin, inicjuje następnie potok szkodliwych efektów, które jeżeli nie są kontrolowane, przyczyniają się do powstania wielu chorób zwyrodnieniowych.[9]
Magazynowanie zbędnego tłuszczu w organizmie następuje kiedy preadipocytowe komórki macierzyste dojrzewają w celu akumulacji nadmiaru tłuszczu pochodzącego z diety (adipogeneza), a zdolność do rozkładania zmagazynowanego tłuszczu (lipoliza) maleje.
- Epidemia otyłości wciąż się rozrasta, obecnie ponad dwie trzecie amerykańskiej populacji ma nadwagę bądź jest otyła.

- Konwencjonalna medycyna nie znalazła jak dotąd bezpiecznego, długotrwałego, praktycznego rozwiązania tego problemu.
- Nowatorskie badania nadal identyfikują nowe, naturalne czynniki zmniejszające wagę.
- Jedną z najnowszych metod jest podwójny ekstrakt z roślin pochodzenia azjatyckiego - Sphaeranthus indicus i owoców mangostanu.
- Rezultatem połączenia wyciągów roślinnych był sprzyjający wpływ na 6 różnych biomolekularnych ścieżek, poprzez które komórki tłuszczowe powodują przybieranie na wadze. W kontrolowanych za pomocą grup placebo próbach klinicznych, obejmujących otyłe osoby, u których występowała otyłość brzuszna, suplementacja w bezpieczny sposób wywołała utratę wagi o 5,17 kg, spadek o 2,05 punkty w indeksie masy ciała (BMI) i redukcję o 10,28 cm w obwodzie w szkodliwym trzewnym tłuszczu już po ośmiu tygodniach stosowania.[10]
Walka z nadmiernym magazynowaniem tłuszczu w organizmie
Szukając naturalnych metod, które skutecznie zahamowałyby akumulację tłuszczów (adipogenezę) i poprawiłyby spalanie tłuszczu (lipoliza), naukowcy zbadali ponad tysiąc roślin.[11]
Spośród nich znaczne biologiczne efekty wykazały dwie rośliny:
- Kwiat Sphaeranthus indicus (S. indicus);[12]
- Owoc mangostanu (Garcinia mangostana).[13]
W warunkach laboratoryjnych obie te rośliny wykazały potężne właściwości hamujące adipogenezę.
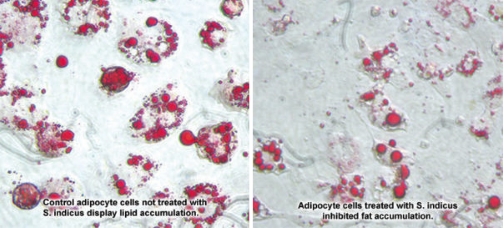
Po leczeniu komórek samą S. indicus, magazynowanie tłuszczu zostało zahamowane aż o 65%, w porównaniu z kontrolnymi komórkami. Poniższe fotografie przedstawiają wyraźnie dostrzegalną różnicę między dwoma grupami komórek. W porównaniu z kontrolnymi - napęczniałymi, nabrzmiałymi od kropelek tłuszczu, komórki leczone wyciągiem S.indicus były mniejsze i miały naturalniejszy kształt.[14]
 Każdy z tych wyciągów zwiększył również lipolizę (spalanie tłuszczów) - aż o 56% w porównaniu z komórkami kontrolnymi.[15]
Każdy z tych wyciągów zwiększył również lipolizę (spalanie tłuszczów) - aż o 56% w porównaniu z komórkami kontrolnymi.[15]
Identyfikując te zbliżone właściwości w dwóch wyciągach, naukowcy postanowili sprawdzić czy ich połączenie mogłoby poprawić te efekty.
Odkryli, że S. indicus i wyciąg z mangostanu sprzyjająco modulują aktywność 6 genomowych ścieżek, związanych z tworzeniem i rozkładem komórek tłuszczowych.[16]
Co ciekawe, ekstrakty te redukują ekspresję genów, wspomagających adipogenezę, przy jednoczesnym korzystnym wpływie na geny związane z pożądaną lipolizą.
Biorąc pod uwagę te obserwacje, naukowcy uznali, że nowa mieszanka roślinnych ekstraktów mogłaby doprowadzić do znacznej utraty wagi poprzez trzy różne mechanizmy:
- Zapobiegając “młodym” komórkom tłuszczowym (preadipocytom) rozwinąć się do “dojrzałych” form (adipocytów).
- Zmniejszając ilość kwasów tłuszczowych w adipocytach, które mogłyby zostać zabsorbowane.
- Przyspieszając rozkład zmagazynowanego tłuszczu w napęczniałych adipocytach.
Następny krok miał ustalić czy te wyciągi roślinne mogłyby wywołać utratę wagi u zwierząt doświadczalnych i co ważniejsze — u otyłych ludzi.
Zapobieganie otyłości u gryzoni
Dojrzałe szczury karmione wysokotłuszczową dietą - podobnie jak ludzie - szybko przybierają na wadze.
Aby zbadać wpływ wyciągu roślinnego, który potwierdzono w badaniach na komórkach, naukowcy karmili grupę dojrzałych szczurów wysokotłuszczową dietą. Połowa gryzoni otrzymywała podwójny wyciąg roślinny, a druga służyła jako grupa kontrolna.[17]
 Na końcu ośmiotygodniowej próby, grupa kontrolna szybko zyskała na wadze. Natomiast szczury karmione wysokotłuszczową dietą i spożywające podwójny wyciąg roślinny, zmniejszyły przyrost wagi aż o 700%.[18]
Na końcu ośmiotygodniowej próby, grupa kontrolna szybko zyskała na wadze. Natomiast szczury karmione wysokotłuszczową dietą i spożywające podwójny wyciąg roślinny, zmniejszyły przyrost wagi aż o 700%.[18]
Nic dziwnego, biorąc pod uwagę, że w modelu komórkowym same wyciągi roślinne zablokowały akumulację tłuszczu o 48,5 % i 65,9 %.[19]
Badania wykazały, że te roślinne wyciągi zmniejszają otyłość wywołaną przez dietę u dojrzałych szczurów. Jednak prawdziwym wyzwaniem, było ustalenie czy ekstrakty będą równie skuteczne u osób, które już mają dużą nadwagę.
Poniżej opisano sposób w jaki te wyciągi roślinne, stosowane same bądź w połączeniu, pozytywnie modulują markery związane ze zbędną akumulacją komórkową tłuszczów dzięki hamowaniu adipogenezy i promowaniu lipolizy.
Nowa mieszanka wyciągu z S. indicus i mangostanu hamuje ekspansję nowych komórek tłuszczowych, promując rozkład lipidów w istniejących adipocytach. Badania laboratoryjne dowodzą następujących mechanizmów molekularnych, które umożliwiają tym dwóm roślinom zwalczenie przeciążenia adipocytów:
- Białko związane z różnicowaniem adipocytów (adipofilina): pobudza akumulację lipidów i formację kropelek lipidów w komórkach tłuszczowych.[20] Uważa się, że redukcja poziomu adipofiliny jest nową strategią w zapobieganiu lub zmniejszaniu niebezpiecznej akumulacji tłuszczu, szczególnie w wątrobie.[21]
- Adipocytowe kwasy tłuszczowe wiążące białka [22]: znane również jako aP2, transportują kwasy tłuszczowe do komórek tłuszczowych w celu przechowywania. Zwiększone poziomy aP2 są związane z nieprawidłowymi profilami lipidowymi, które prowadzą do miażdżycy. Mogą również być niezależnym czynnikiem ryzyka dla zespołu metabolicznego i choroby sercowo-naczyniowej.[23]
- Perilipina: białko, pokrywa kropelki lipidów w adipocytach, chroniąc tym samym ich tłuszczową zawartości przed rozłożeniem. Hamowanie perilipin zwiększa w ten sposób lipolizę, przyczyniając się do redukcji zawartości tłuszczów w adipocytach.[24]
- Inhibitor aktywatorów plazminogenu typu 1 (PAI-1): Produkowany głównie przez komórki śródbłonka (wyścielających tętnice), PAI-1 odgrywa kluczową rolę w rozkładzie i formacji zakrzepów krwi.[25] Uwalniany jest również przez tkankę tłuszczową.[26] Wysokie poziomy PAI-1 korelują w ten sposób bezpośrednio z otyłością brzuszną, wagą ciała i wskaźnikiem masy ciała - BMI.[27] Odkryto, że w obecności nowej mieszanki wyciągu roślinnego, poziom PAI-1 ostatecznie uległ znacznej redukcji.[28]
- PPAR-gamma (receptory gamma aktywowane przez proliferatory peroksysomów): główny metaboliczny “sensor”, który wywołuje adipogenezę w obecności dodatkowych kalorii.[29] Redukcja aktywności PPAR-gamma pomaga zapobiec komórkom tłuszczowym przed staniem się napęczniałymi i metabolicznie zaburzonymi.[30]
- Receptory beta 3 adrenergiczne (3AR): ekspresja genów tego nowo odkrytego receptora uległa zwiększeniu dzięki stosowaniu podwójnego ekstraktu roślinnego. Reguluje on rozkład tłuszczów (lipolizę) w chwilach zwiększonego zapotrzebowania na energię. Rozpoczęcie działania tego receptora beta 3 spontanicznie i spektakularnie zwiększa wydatek energii komórek tłuszczowych, spalając niewykorzystany tłuszcz.[31]
Naukowcy wykazali, że dzięki wyciągom z S. indicus i mangostanu sprzyjająco modulowane jest sześć genomowych ścieżek, związanych z tworzeniem i rozkładem komórek tłuszczowych.[32] Dało to naukowcom podstawę do wyjaśnienia ich właściwościom przeciwdziałającym otyłości u ludzi.
Utrata wagi u ludzi
Ludzkie badania nad utratą wagi objęły grupę osób, które otrzymały potencjalnie efektywny czynnik redukujący tłuszcz oraz tych, otrzymujących obojętne placebo.
Aby ocenić efekty tych dwóch wyciągów roślinnych, 60 otyłych osób podzielono na dwie grupy. Pierwsza z nich była poddawana działaniu placebo, a 30 kolejnych pacjentów otrzymywało 800 mg/dzień połączenia dwóch ekstraktów roślinnych. Wszyscy badani stosowali dietę zawierającą 2 000 kalorii na dzień i spacerowali przez 30 minut pięć dni w tygodniu.
Na końcu ośmiotygodniowej próby, w grupie otrzymującej dwa roślinne wyciągi wykazano następującą poprawę:[33]
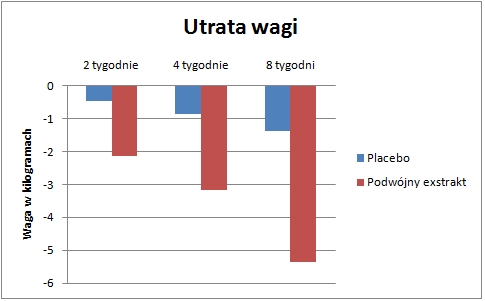
- redukcja całkowitej wagi ciała o 5,17 kg ( 3,7 razy większa niż w grupie placebo);
- redukcja o 10,29 cm w obwodzie brzucha (2 razy większa niż w grupie placebo);
- redukcja w indeksie masy ciała (BMI) o 2,05 punkta. (3,9 razy większa niż w grupie placebo).
 To ustalone losowo, kontrolowane za pomocą grupy placebo i przeprowadzone metodą podwójnie ślepej próby badanie, zleca agencja FDA (Amerykańska Agencja ds. Żywności i Leków) za każdym razem zanim zaakceptuje nowy lek. Fotografie zamieszczone w tym artykule przedstawiają stopień utraty wagi i redukcji tłuszczu brzusznego, który wystąpił w grupie otrzymującej podwójny wyciąg roślinny w porównaniu z placebo.[34] (Zobacz wykres nr 1 i 2)
To ustalone losowo, kontrolowane za pomocą grupy placebo i przeprowadzone metodą podwójnie ślepej próby badanie, zleca agencja FDA (Amerykańska Agencja ds. Żywności i Leków) za każdym razem zanim zaakceptuje nowy lek. Fotografie zamieszczone w tym artykule przedstawiają stopień utraty wagi i redukcji tłuszczu brzusznego, który wystąpił w grupie otrzymującej podwójny wyciąg roślinny w porównaniu z placebo.[34] (Zobacz wykres nr 1 i 2)
Oprócz pozytywnych wyników obserwowanych podczas ośmiu tygodni próby, naukowcy byli pod wrażeniem redukcji w obwodzie talii i bioder, jak również utraty wagi ciała, która wystąpiła w pierwszych 14 dniach (średnia redukcja wagi to 2,1 kg)! [35]
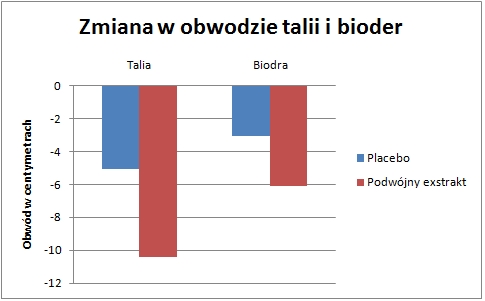
Podczas ośmiu tygodni próby, w grupie stosującej podwójny wyciąg roślinny zaobserwowano widoczną obniżkę stosunku obwodu talii do obwodu bioder, która była o 2,2 razy większa niż w u przyjmujących placebo. Utrata tkanki tłuszczowej w tym właśnie miejscu daje bardzo pozytywne efekty zdrowotne.
Odkrycia te potwierdza druga, podobna próba obejmująca 60 otyłych osób. Zostali oni podzieleni na trzy grupy - pierwsza otrzymywała placebo, druga jeden wyciąg, a ostatnia podwójny ekstrakt roślinny. Wszyscy uczestnicy przyjmowali dietę składającą się z 2 000 kalorii na dzień i spacerowali przez 30 minut pięć razy w tygodniu przez 8 tygodni.[36]
Po ośmiu tygodniach grupa otrzymująca podwójny wyciąg, doświadczyła statystycznie istotnych zmian w obwodzie brzucha, całkowitej wadze ciała i obwodu bioder, podobnych do tych obserwowanych we wcześniej wspomnianym badaniu.[37]
Te potwierdzające odkrycia wskazują, że nowy, podwójny wyciąg roślinny może umożliwić starzejącym się ludziom bezpieczne zrzucanie zbędnego zapasu tłuszczu. Ponadto, nie zanotowano żadnych niepożądanych objawów lub skutków ubocznych.
Wykres nr 1
Wykres nr 2
Ochrona przed zakrzepicą tętnicy wieńcowej

Najczęściej nagłe, śmiertelne ataki serca występują kiedy skrzepy krwi tworzą się w tętnicy wieńcowej, nie pozwalając na przepływ utlenionej krwi do partii mięśnia sercowego.
Białko zwane inhibitorem aktywatorów plazminogenu typu 1 (PAI-1) hamuje normalny rozkład skrzepów krwi w tętnicy.[38] Wysokie poziomy PAI-1 występujące u otyłych osób, są związane z większym ryzykiem ataku serca.[39]
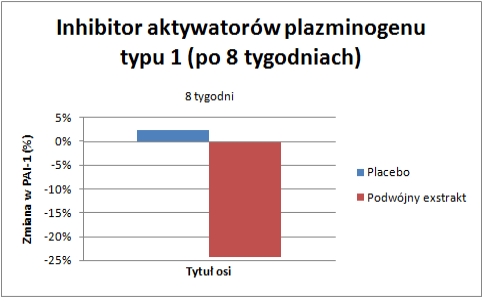
Podczas badań nad podwójnym wyciągiem roślinnym, naukowcy zmierzyli poziom inhibitora aktywatorów plazminogenu typu 1 w osoczu. U osób przyjmujących ekstrakt, wykazano 24,3 % redukcję niebezpiecznego stanu PAI-1, natomiast w grupie placebo zaobserwowano 2,4 % wzrost.[40] (Zobacz wykres nr 3)
U stosujących suplementację zaobserwowano 60% spadek poziomu triglicerydów.[41]
Podwójny wyciąg roślinny zwiększył również poziom kluczowego metabolicznego hormonu - adiponektyny.[42] Adiponektyna reguluje ilość cukru w krwiobiegu i szybkość rozkładu tłuszczów w organizmie. Wysokie poziomy adiponektyny wiążą się ze zredukowanymi depozytami tłuszczu i zmniejszoną podatnością na cukrzycę i zespół metaboliczny.[43]
W grupie stosującej suplementację wykazano tendencję w kierunku zredukowania glukozy i cholesterolu, czego można się spodziewać w odpowiedzi na utratę tłuszczu brzusznego i spadek wagi ciała.[44]
Utrata tłuszczu trzewnego w grupie stosującej podwójny wyciąg — o 10,27 cm (dwa razy większy niż w grupie placebo) — jest bardzo ważna, [45] ponieważ tłuszcz brzuszny uwalnia potok prozapalnych molekuł komórkowej sygnalizacji. Dodatkowy tłuszcz jest znanym czynnikiem ryzyka dla kilku poważnych problemów zdrowotnych, począwszy od zapalenia ogólnoustrojowego, a skończywszy na zwiększonym ryzyku nadciśnienia, miażdżycy, cukrzycy typu 2 i choroby tętnicy wieńcowej.[46]
Odkrycia wskazały, że u otyłych osób, które zażywały 800 mg/dzień podwójnego wyciągu roślinnego, zaobserwowano znaczną redukcję ryzyka choroby naczyniowej.
Wykres nr 3
Potężne właściwości przeciwcukrzycowe
 Naukowcy potwierdzili, że wyciąg z Sphaeranthus indicus (S. indicus) i owoców mangostenu (Garcinia mangostana), od dawna ceniony w tradycyjnej medycynie ajuwerdyjskiej powoduje utratę wagi, wykorzystując swoje przeciwcukrzycowe zdolności u ludzi.
Naukowcy potwierdzili, że wyciąg z Sphaeranthus indicus (S. indicus) i owoców mangostenu (Garcinia mangostana), od dawna ceniony w tradycyjnej medycynie ajuwerdyjskiej powoduje utratę wagi, wykorzystując swoje przeciwcukrzycowe zdolności u ludzi.
S. indicus stosowana była od wieków w zwalczaniu objawów cukrzycy, ochronie wątroby, tłumienia stanów zapalnych, poprawy nastroju i wspomaganiu trawienia.[48]
U cierpiących na cukrzycę zwierząt, leczonych wyciągiem S. indicus wykazano znaczną redukcje poziomu glukozy we krwi oraz poprawę funkcji wątroby i trzustki.[49] U myszy cierpiących na insulinoodporność, ekstrakt ten obniżył stan cukru i trójglicerydów we krwi, umożliwiając skuteczniejszą absorpcję glukozy w tkankach mięśniowych.[50] Zaobserwowano u nich również znacznie niższe poziomy utlenienia tkanki, [51] główny, pierwotny czynnik powodujący większość zagrażających życiu komplikacji cukrzycowych.[52]
Mangostan jest jadalnym owocem, który rośnie w Południowej Azji. Podobnie jak w przypadku S. indicus, jego owoce i sok są stosowane od wieków w zwalczaniu cukrzycy i otyłości. Jednym z jego istotnych właściwości jest zdolność do blokowania zasadniczego metabolicznego enzymu alfa-amylazy, który rozkłada skrobia do postaci cukru.[53] Blokada alfa amylazy ogranicza skoki poziomów glukozy we krwi, które zwykle następują po bogatym w węglowodany posiłku. Wyciąg z mangostanu hamuje również enzymy związane z syntetyzowaniem cząsteczek tłuszczu.[54] Jest to połączenie hamujące absorpcję cukru i produkcję tłuszczów, w znacznej części odpowiadające za jego zdolności do wspomagania utraty wagi.
Wyciąg z mangostanu przynosi dodatkową, godną uwagi korzyść. Wykazano, że skutecznie ogranicza stany zapalne, które zazwyczaj towarzyszą akumulacji komórek tłuszczowych.[55] Te stany zapalne przyczyniają się bezpośrednio do insulinodporności. W pewnym badaniu u otyłych osób stosujących suplementację z sokiem z mangostanu, poziom zapalnego markera białka C reaktywnego uległ znacznemu zmniejszeniu [56] już po 8 tygodniach.
Podsumowanie
Otyłość powstaje w wyniku powiększania się rozmiaru pojedynczych adipocytów (komórek tłuszczowych) i wzmożonej akumulacji lipidów (tłuszczu). Nasila się wraz z większą liczbą preadipocytów przekształcających się do patologicznych, napęczniałych adipocytów.
Nowa mieszanka wyciągów roślinnych przedstawiona w tym artykule sprzyjająco wpływa na sześć odmiennych ścieżek, poprzez które komórki tłuszczowe powodują przybieranie na wadzę.
W kulturach komórkowych, te ekstrakty roślinne zmniejszają zdolność prekursorów komórek tłuszczowych (preadipocytów) do przekształcanie się do napęczniałych komórek tłuszczowych. Badania wykazały również, że komponenty podwójnego wyciągu zmniejszają ilość kwasów tłuszczowych pochłanianych przez adipocyty (adipogenezę) i ułatwiają rozkład (lipolizę) zgromadzonego w nich tłuszczu.
W kontrolowanej za pomocą grupy placebo próbie klinicznej, obejmującej otyłe osoby, mieszanka wyciągu z S. indicus i mangostanu w sposób bezpieczny spowodowała 5,17 kg utratę wagi, zmniejszyła indeks masy ciała (BMI) o 2,05 i zredukowała obwód szkodliwego trzewnego tłuszczu o 10,28 cm.[47]
Podczas gdy medycyna konwencjonalna nie oferuje żadnego bezpiecznego, długotrwałego, praktycznego rozwiązania dla dzisiejszej epidemii otyłości, dostępne są obecnie naturalne czynniki, które skutecznie wspomagają efekty rozsądnego programu utraty wagi.
Materiał wykorzystany za zgodą Life Extension. Wszelkie prawa zastrzeżone.
[1] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[2] Bunnell BA, Estes BT, Guilak F, Gimble JM. Differentiation of adipose stem cells. Methods Mol Biol. 2008;456:155-71
Symonds ME, Budge H, Perkins AC, Lomax MA. Adipose tissue development – Impact of the early life environment. Prog Biophys Mol Biol. 2010 Dec 14.
[3] Takakura Y, Yoshida T. Beta 3-adrenergic receptor agonists–past, present and future. Nippon Yakurigaku Zasshi. 2001 Nov;118(5):315-20.
[4] Xiao L, Zhang J, Li H, Liu J, He L, Zhai Y. Inhibition of adipocyte differentiation and adipogenesis by the traditional Chinese herb Sibiraea angustata. Exp Biol Med (Maywood). 2010 Dec;235(12):1442-9.
Bumrungpert A, Kalpravidh RW, Chuang CC, et al. Xanthones from mangosteen inhibit inflammation in human macrophages and in human adipocytes exposed to macrophage-conditioned media. J Nutr. 2010 Apr;140 (4):842-7.
[5] Amini Z, Boyd B, Doucet J, Ribnicky DM, Stephens JM. St. John’s Wort inhibits adipocyte differentiation and induces insulin resistance in adipocytes. Biochem Biophys Res Commun. 2009 Oct 9;388(1):146-9.
[6] Frayn KN, Fielding BA, Karpe F. Adipose tissue fatty acid metabolism and cardiovascular disease. Curr Opin Lipidol. 2005 Aug;16(4):409-15.
Wang S, Soni KG, Semache M, et al. Lipolysis and the integrated physiology of lipid energy metabolism. Mol Genet Metab. 2008 Nov;95(3):117-26.
[7] Amini Z, Boyd B, Doucet J, Ribnicky DM, Stephens JM. St. John’s Wort inhibits adipocyte differentiation and induces insulin resistance in adipocytes. Biochem Biophys Res Commun. 2009 Oct 9;388(1):146-9.
Lee J, Jung E, Huh S, Kim YS, Kim YW, Park D. Anti-adipogenesis by 6-thioinosine is mediated by downregulation of PPAR gamma through JNK-dependent upregulation of iNOS. Cell Mol Life Sci. 2010 Feb;67(3):467-81.
Smas CM, Sul HS. Molecular mechanisms of adipocyte differentiation and inhibitory action of pref-1. Crit Rev Eukaryot Gene Expr. 1997;7(4):281-98.
Fan B, Ikuyama S, Gu JQ, et al. Oleic acid-induced ADRP expression requires both AP-1 and PPAR response elements, and is reduced by Pycnogenol through mRNA degradation in NMuLi liver cells. Am J Physiol Endocrinol Metab. 2009 Jul;297(1):E112-23.
[8] Takakura Y, Yoshida T. Beta 3-adrenergic receptor agonists–past, present and future. Nippon Yakurigaku Zasshi. 2001 Nov;118(5):315-20.
[9] Xiao L, Zhang J, Li H, Liu J, He L, Zhai Y. Inhibition of adipocyte differentiation and adipogenesis by the traditional Chinese herb Sibiraea angustata. Exp Biol Med (Maywood). 2010 Dec;235(12):1442-9.
Bumrungpert A, Kalpravidh RW, Chuang CC, et al. Xanthones from mangosteen inhibit inflammation in human macrophages and in human adipocytes exposed to macrophage-conditioned media. J Nutr. 2010 Apr;140 (4):842-7.
[10] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[11] Results based on initial analyses of unpublished research data.
[12] Results based on initial analyses of unpublished research data.
[13] Results based on initial analyses of unpublished research data.
[14] Results based on initial analyses of unpublished research data.
[15] Results based on initial analyses of unpublished research data.
[16] Results based on initial analyses of unpublished research data.
[17] Results based on initial analyses of unpublished research data.
[18] Results based on initial analyses of unpublished research data.
[19] Results based on initial analyses of unpublished research data.
[20] Results based on initial analyses of unpublished research data.
Imamura M, Inoguchi T, Ikuyama S, et al. ADRP stimulates lipid accumulation and lipid droplet formation in murine fibroblasts. Am J Physiol Endocrinol Metab. 2002 Oct;283(4):E775-83.
[21] Fan B, Ikuyama S, Gu JQ, et al. Oleic acid-induced ADRP expression requires both AP-1 and PPAR response elements, and is reduced by Pycnogenol through mRNA degradation in NMuLi liver cells. Am J Physiol Endocrinol Metab. 2009 Jul;297(1):E112-23.
Results based on initial analyses of unpublished research data.
Grasselli E, Voci A, Canesi L, et al. Direct effects of iodothyronines on excess fat storage in rat hepatocytes. J Hepatol. 2010 Nov 3.
Imai Y, Varela GM, Jackson MB, Graham MJ, Crooke RM, Ahima RS. Reduction of hepatosteatosis and lipid levels by an adipose differentiation-related protein antisense oligonucleotide. Gastroenterology. 2007 May;132(5):1947-54.
[22] Takakura Y, Yoshida T. Beta 3-adrenergic receptor agonists–past, present and future. Nippon Yakurigaku Zasshi. 2001 Nov;118(5):315-20.
[23] Frayn KN, Fielding BA, Karpe F. Adipose tissue fatty acid metabolism and cardiovascular disease. Curr Opin Lipidol. 2005 Aug;16(4):409-15.
Smas CM, Sul HS. Molecular mechanisms of adipocyte differentiation and inhibitory action of pref-1. Crit Rev Eukaryot Gene Expr. 1997;7(4):281-98.
Agardh HE, Folkersen L, Ekstrand J, et al. Expression of fatty acid-binding protein 4/aP2 is correlated with plaque instability in carotid atherosclerosis. J Intern Med. 2011 Feb;269(2):200-10.
Aragones G, Ferre R, Lazaro I, et al. Fatty acid-binding protein 4 is associated with endothelial dysfunction in patients with type 2 diabetes. Atherosclerosis. 2010 Nov;213(1):329-31.
Cabre A, Lazaro I, Cofan M, et al. FABP4 plasma levels are increased in familial combined hyperlipidemia. J Lipid Res. 2010 May;51(5):1173-8.
Cabre A, Lazaro I, Girona J, et al. Plasma fatty acid binding protein 4 is associated with atherogenic dyslipidemia in diabetes. J Lipid Res. 2008 Aug;49(8):1746-51.
Chmurzynska A. The multigene family of fatty acid-binding proteins (FABPs): function, structure and polymorphism. J Appl Genet. 2006;47(1):39-48.
Karakas SE, Almario RU, Kim K. Serum fatty acid binding protein 4, free fatty acids, and metabolic risk markers. Metabolism. 2009 Jul;58(7):1002-7.
Kersten S. Mechanisms of nutritional and hormonal regulation of lipogenesis. EMBO Rep. 2001 Apr;2(4):282-6.
Toruner F, Altinova AE, Akturk M, et al. The relationship between adipocyte fatty acid binding protein-4, retinol binding protein-4 levels and early diabetic nephropathy in patients with type 2 diabetes. Diabetes Res Clin Pract. 2010 Dec 19.
Tsai JP, Liou HH, Liu HM, Lee CJ, Lee RP, Hsu BG. Fasting serum fatty acid-binding protein 4 level positively correlates with metabolic syndrome in hemodialysis patients. Arch Med Res. 2010 Oct;41(7):536-40.
[24] Wang S, Soni KG, Semache M, et al. Lipolysis and the integrated physiology of lipid energy metabolism. Mol Genet Metab. 2008 Nov;95(3):117-26.
Li Y, Kang Z, Li S, Kong T, Liu X, Sun C. Ursolic acid stimulates lipolysis in primary-cultured rat adipocytes. Mol Nutr Food Res. 2010 Nov;54(11):1609-17.
Nerurkar PV, Lee YK, Nerurkar VR. Momordica charantia (bitter melon) inhibits primary human adipocyte differentiation by modulating adipogenic genes. BMC Complement Altern Med. 2010;10:34.
Tinahones FJ, Garrido-Sanchez L, Miranda M, et al. Obesity and insulin resistance-related changes in the expression of lipogenic and lipolytic genes in morbidly obese subjects. Obes Surg. 2010 Nov;20(11):1559-67.
[25] Mutch NJ, Thomas L, Moore NR, Lisiak KM, Booth NA. TAFIa, PAI-1 and alpha-antiplasmin: complementary roles in regulating lysis of thrombi and plasma clots. J Thromb Haemost. 2007 Apr;5(4):812-7.
[26] Trayhurn P, Wood IS. Signalling role of adipose tissue: adipokines and inflammation in obesity. Biochem Soc Trans. 2005 Nov;33(Pt 5):1078-81.
[27] Gnacinska M, Malgorzewicz S, Guzek M, Lysiak-Szydłowska W, Sworczak K. Adipose tissue activity in relation to overweight or obesity. Endokrynol Pol. 2010 Mar-Apr;61(2):160-8.
[28] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[29] Cock TA, Houten SM, Auwerx J. Peroxisome proliferator-activated receptor-gamma: too much of a good thing causes harm. EMBO Rep. 2004 Feb;5(2):142-7.
[30] Jiang HZ, Quan XF, Tian WX, et al. Fatty acid synthase inhibitors of phenolic constituents isolated from Garcinia mangostana. Bioorg Med Chem Lett. 2010 Oct 15;20(20):6045-7.
Choi JH, Banks AS, Estall JL, et al. Anti-diabetic drugs inhibit obesity-linked phosphorylation of PPARgamma by Cdk5. Nature. 2010 Jul 22;466(7305):451-6.
Oben JE, Ngondi JL, Blum K. Inhibition of Irvingia gabonensis seed extract (OB131) on adipogenesis as mediated via down regulation of the PPARgamma and leptin genes and up-regulation of the adiponectin gene. Lipids Health Dis. 2008;7:44.
Tsukahara T, Hanazawa S, Murakami-Murofushi K. Cyclic phosphatidic acid influences the expression and regulation of cyclic nucleotide phosphodiesterase 3B and lipolysis in 3T3-L1 cells. Biochem Biophys Res Commun. 2011 Jan 7;404(1):109-14.
Amini Z, Boyd B, Doucet J, Ribnicky DM, Stephens JM. St. John’s Wort inhibits adipocyte differentiation and induces insulin resistance in adipocytes. Biochem Biophys Res Commun. 2009 Oct 9;388(1):146-9.
Wang S, Soni KG, Semache M, et al. Lipolysis and the integrated physiology of lipid energy metabolism. Mol Genet Metab. 2008 Nov;95(3):117-26.
Imamura M, Inoguchi T, Ikuyama S, et al. ADRP stimulates lipid accumulation and lipid droplet formation in murine fibroblasts. Am J Physiol Endocrinol Metab. 2002 Oct;283(4):E775-83.
[31] Bumrungpert A, Kalpravidh RW, Chuang CC, et al. Xanthones from mangosteen inhibit inflammation in human macrophages and in human adipocytes exposed to macrophage-conditioned media. J Nutr. 2010 Apr;140 (4):842-7.
An S, Han JI, Kim MJ, et al. Ethanolic extracts of Brassica campestris spp. rapa roots prevent high-fat diet-induced obesity via beta(3)-adrenergic regulation of white adipocyte lipolytic activity. J Med Food. 2010 Apr;13(2):406-14.
Hatakeyama Y, Sakata Y, Takakura S, Manda T, Mutoh S. Acute and chronic effects of FR-149175, a beta 3-adrenergic receptor agonist, on energy expenditure in Zucker fatty rats. Am J Physiol Regul Integr Comp Physiol. 2004 Aug;287(2):R336-41.
Lima JJ, Feng H, Duckworth L, et al. Association analyses of adrenergic receptor polymorphisms with obesity and metabolic alterations. Metabolism. 2007 Jun;56(6):757-65.
Sakura H, Togashi M, Iwamoto Y. Beta 3-adrenergic receptor agonists as anti-obese and anti-diabetic drugs. Nippon Rinsho. 2002 Jan;60(1):123-9.
van Baak MA, Hul GB, Toubro S, et al. Acute effect of L-796568, a novel beta 3-adrenergic receptor agonist, on energy expenditure in obese men. Clin Pharmacol Ther. 2002 Apr;71(4):272-9.
[32] Agardh HE, Folkersen L, Ekstrand J, et al. Expression of fatty acid-binding protein 4/aP2 is correlated with plaque instability in carotid atherosclerosis. J Intern Med. 2011 Feb;269(2):200-10.
[33] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[34] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[35] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[36] Results based on initial analyses of unpublished research data.
[37] Results based on initial analyses of unpublished research data.
[38] Mutch NJ, Thomas L, Moore NR, Lisiak KM, Booth NA. TAFIa, PAI-1 and alpha-antiplasmin: complementary roles in regulating lysis of thrombi and plasma clots. J Thromb Haemost. 2007 Apr;5(4):812-7.
[39] Trayhurn P, Wood IS. Signalling role of adipose tissue: adipokines and inflammation in obesity. Biochem Soc Trans. 2005 Nov;33(Pt 5):1078-81.
Gnacinska M, Malgorzewicz S, Guzek M, Lysiak-Szydłowska W, Sworczak K. Adipose tissue activity in relation to overweight or obesity. Endokrynol Pol. 2010 Mar-Apr;61(2):160-8.
[40] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[41] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[42] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[43] Ukkola O, Santaniemi M. Adiponectin: a link between excess adiposity and associated comorbidities? J Mol Med. 2002 Nov;80(11):696-702.
[44] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[45] Lau FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[46] Koh H, Hayashi T, Sato KK, et al. Visceral adiposity, not abdominal subcutaneous fat area, is associated with high blood pressure in Japanese men: the Ohtori study. Hypertens Res. 2011 Jan 13.
Lee YH, Lee SH, Jung ES, et al. Visceral adiposity and the severity of coronary artery disease in middle-aged subjects with normal waist circumference and its relation with lipocalin-2 and MCP-1. Atherosclerosis. 2010 Dec;213(2):592-7.
Navarro E, Mijac V, Ryder HF. Ultrasonography measurement of intrabdominal visceral fat in obese men. Association with alterations in serum lipids and insulinemia. Arch Latinoam Nutr. 2010 Jun;60(2):160-7.
[47] La u FC, Golakoti T, Krishnaraju AV, Sengupta K, Bagchi D. Efficacy and tolerability of Merastin™- A randomized, double-blind, placebo-controlled study. FASEB J. April 2011; 25:(Meeting Abstract Supplement) 601.9. Presented at Experimental Biology 2011, Washington, DC. April 10, 2011. Program No. 601.9, Poster No. A278.
[48] Galani VJ, Patel BG, Rana DG. Sphaeranthus indicus Linn.: A phytopharmacological review. Int J Ayurveda Res. 2010 Oct;1(4):247-53.
[49] Prabhu KS, Lobo R, Shirwaikar A. Antidiabetic properties of the alcoholic extract of Sphaeranthus indicus in streptozotocin-nicotinamide diabetic rats. J Pharm Pharmacol. 2008 Jul;60(7):909-16.
Ramachandran S, Asokkumar K, Uma Maheswari M, et al. Investigation of Antidiabetic, Antihyperlipidemic, and In Vivo Antioxidant Properties of Sphaeranthus indicus Linn. in Type 1 Diabetic Rats: An Identification of Possible Biomarkers. Evid Based Complement Alternat Med. 2011;2011.
[50] Ghaisas M, Zope V, Takawale A, Navghare V, Tanwar M, Deshpande A. Preventive effect of Sphaeranthus indicus during progression of glucocorticoid-induced insulin resistance in mice. Pharm Biol. 2010 Dec;48(12):1371-5.
[51] Shirwaikar A, Prabhu KS, Punitha IS. In vitro antioxidant studies of Sphaeranthus indicus (Linn). Indian J Exp Biol. 2006 Dec;44(12):993-6.
[52] Ramachandran S, Asokkumar K, Uma Maheswari M, et al. Investigation of Antidiabetic, Antihyperlipidemic, and In Vivo Antioxidant Properties of Sphaeranthus indicus Linn. in Type 1 Diabetic Rats: An Identification of Possible Biomarkers. Evid Based Complement Alternat Med. 2011;2011.
Ghaisas M, Zope V, Takawale A, Navghare V, Tanwar M, Deshpande A. Preventive effect of Sphaeranthus indicus during progression of glucocorticoid-induced insulin resistance in mice. Pharm Biol. 2010 Dec;48(12):1371-5.
[53] Loo AE, Huang D. Assay-guided fractionation study of alpha-amylase inhibitors from Garcinia mangostana pericarp. J Agric Food Chem. 2007 Nov 28;55(24):9805-10.
[54] Jiang HZ, Quan XF, Tian WX, et al. Fatty acid synthase inhibitors of phenolic constituents isolated from Garcinia mangostana. Bioorg Med Chem Lett. 2010 Oct 15;20(20):6045-7.
[55] Bumrungpert A, Kalpravidh RW, Chitchumroonchokchai C, et al. Xanthones from mangosteen prevent lipopolysaccharide-mediated inflammation and insulin resistance in primary cultures of human adipocytes. J Nutr. 2009 Jun;139(6):1185-91.
[56] Udani JK, Singh BB, Barrett ML, Singh VJ. Evaluation of Mangosteen juice blend on biomarkers of inflammation in obese subjects: a pilot, dose finding study. Nutr J. 2009;8:48.


