Doustne probiotyki zwalczają choroby dziąseł
 W dobie pandemii COVID-19 dbanie o higienę jamy ustnej wydaję się być szczególnie istotne. W jamie ustnej znajduje się ogromna ilość bakterii, które mogą powodować ubytki zębów a także zapalenie przyzębia. Nawet dobre nawyki higieny jamy ustnej polegające na szczotkowaniu i nitkowaniu zębów dwa razy dziennie mogą okazać się niewystarczające.
W dobie pandemii COVID-19 dbanie o higienę jamy ustnej wydaję się być szczególnie istotne. W jamie ustnej znajduje się ogromna ilość bakterii, które mogą powodować ubytki zębów a także zapalenie przyzębia. Nawet dobre nawyki higieny jamy ustnej polegające na szczotkowaniu i nitkowaniu zębów dwa razy dziennie mogą okazać się niewystarczające.
Prawie jedna trzecia dorosłych Amerykanów cierpi na próchnicę, a prawie połowa osób w wieku lat 30 i starszych cierpi na choroby przyzębia.1,2
Choroby dziąseł bywają bardzo poważne. Mogą one prowadzić do utraty zębów, a także stanów zapalnych, które z kolei mogą przyspieszać procesy zwyrodnieniowe związane ze starzeniem.3 Choroby dziąseł mogą być przyczyną problemów z sercem a nawet nowotworów. Ponadto chore zęby mogą przyczyniać się do wystąpienia choroby Alzheimera, chorób płuc i nerek oraz innych narządów.4-14
Naukowcy poszukujący sposobu na radzenie sobie z chorobami dziąseł i próchnicą odkryli innowacyjny sposób zmniejszenia ryzyka wystąpienia tych schorzeń - są nim doustne pastylki probiotyczne do ssania.
Mikrobiom jamy ustnej
Drobnoustroje naturalnie występujące w jamie ustnej nazywają się mikrobiomem jamy ustnej. Zdrowy mikrobiom wspomaga i chroni delikatne błony śluzowe, a także powierzchnię samych zębów.
Kiedy równowaga mikrobiomu jamy ustnej zostaje zakłócona - czy to z powodu złej diety, stylu życia, narkotyków czy też chorób - dochodzi do braku równowagi mikrobiologicznej, stan ten nazywany jest dysbiozą. Dysbioza upośledza prawidłową odpowiedź układu odpornościowego na czynniki zapalne.
Dysbioza może powodować szereg problemów w jamie ustnej, w tym także pojawianie się ubytków oraz chorób dziąseł. Te czynniki przyczyniają się do utraty zębów, a także do pojawiania się stanów zapalnych w całym organizmie.
Konieczność przywrócenia równowagi mikrobiomu jamy ustnej doprowadziła naukowców do zidentyfikowania dwóch szczepów pożytecznych bakterii, które mogą zwalczać choroby dziąseł. Pierwszy szczep bakterii probiotycznych, L. plantarum L-137, wzmacnia funkcję odpornościową jamy ustnej i wspomaga proces gojenia. Drugi szczep bakterii probiotycznych, S. salivarius M18, zabija szkodliwe bakterie żyjące w jamie ustnej.15-17
Oba te szczepy bakterii probiotycznych zapobiegają chorobom dziąseł a także wspomagają utrzymanie równowagi mikrobiomu jamy ustnej.
Wykorzystanie naturalnej odpowiedzi immunologicznej
 Jednym z kluczowych problemów związanych z brakiem równowagi mikrobiomu jamy ustnej jest fakt, że zmniejsza on naturalne zdolności odpornościowe jamy ustnej. Z tego też powodu, jesteśmy bardziej narażeni na infekcje bakteriami powodującymi choroby dziąseł, takimi jak Porphyromonas gingivalis.
Jednym z kluczowych problemów związanych z brakiem równowagi mikrobiomu jamy ustnej jest fakt, że zmniejsza on naturalne zdolności odpornościowe jamy ustnej. Z tego też powodu, jesteśmy bardziej narażeni na infekcje bakteriami powodującymi choroby dziąseł, takimi jak Porphyromonas gingivalis.
Bakterie P. gingivalis dodatkowo osłabiają układ odpornościowy jamy ustnej. Zmniejszają one poziom ochronnej Interleukiny 12 (IL-12) i zwiększają poziom prozapalnej Interleukiny 6 (IL-6). Tworzy to swego rodzaju błędne koło, które uniemożliwia organizmowi wyleczenie się.18-20
Naukowcy poszukiwali sposobu na zwiększenie odporności w jamie ustnej i zidentyfikowali nieszkodliwą bakterię Lactobacillus plantarum, szczep L-137.17 Po obróbce cieplnej stwierdzono, że szczep L. plantarum zwiększa produkcję ochronnej IL-12.
Zastosowanie tej bakterii u pacjentów z zapaleniem przyzębia pomaga odbudować prawidłowe funkcje odpornościowe w jamie ustnej, które zostały upośledzone w wyniku działania niepożądanych bakterii szczepu P. gingivalis. L. plantarum pomaga przywrócić naturalną równowagę mikrobiomu jamy ustnej, a tym samym umożliwić szybsze wyleczenie stanów zapalnych dziąseł.
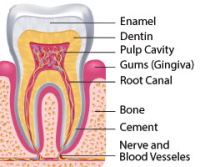
- Choroby zębów i dziąseł są często pomijaną przyczyną pogorszenia stanu zdrowia u osób starzejących się.
- Oprócz negatywnego wpływu na zdrowie jamy ustnej, stany zapalne w obrębie dziąseł mogą powodować choroby serca, płuc, mózgu, wątroby a także schorzenia związane z procesem starzenia się.
- Równowaga mikrobiomu jam ustnej wspomaga odporność.
- Brak równowagi mikrobiomu albo dysbioza upośledza prawidłową odporność jamy ustnej.
- Równoważenie dysbiotycznego mikrobiomu jamy ustnej może przywrócić naturalną odporność na choroby.
- HT-L. plantarum L-137 to poddany obróbce cieplnej szczep pospolitych bakterii Lactobacillus, zdolny do indukowania cytokin prozdrowotnych w jamie ustnej i zwiększania odporności lokalnej.
- S. salivarius M18 to żywy szczep probiotyczny o działaniu antybiotycznym.
- Uzupełnienie codziennego schematu higieny jamy ustnej o suplement zawierający bakterie probiotyczne sprawi że w jamie ustnej nie będą namnażały się niepożądane bakterie, a w związku z tym ryzyko pojawienia się chorób powiązanych ze schorzeniami przyzębia zostanie znacznie zredukowane.
Próby kliniczne
Naukowcy przeprowadzili randomizowane badanie, z udziałem 39 osób z przewlekłym zapaleniem przyzębia.17 Losowo dobrani uczestnicy badania, przez 12 tygodni otrzymywali placebo lub suplement zawierający L. plantarum L-137.
W ciągu 12 tygodni badacze zmierzyli odległość od linii dziąseł do dna maleńkiej „kieszeni” między dziąsłem a korzeniem zęba.17 Normalna, zdrowa kieszonka przyzębna ma maksymalnie 3 mm głębokości, głębokość 4 mm i więcej świadczy natomiast o stanie zapalnym przyzębia21.
Po 12 tygodniach, u osób suplementujących L. plantarum L-137 zaobserwowano 64% redukcję głębokości kieszonki przyzębnej w porównaniu z osobami przyjmującymi placebo.17
To niezwykłe badanie wykazało, że można poprawić stan zdrowia przyzębia poprzez modulację układu odpornościowego jamy ustnej.
Przywrócenie prawidłowej głębokości kieszonki przyzębnej jest jednym z elementów zwiększających naturalną odporność jamy ustnej. Jednak, równie ważne jest także przywrócenie równowagi mikrobiomu jamy ustnej.
W taki sposób można zapobiegać zaburzeniom odporności i spowodowanych nimi zmianami zapalnym, jeszcze zanim takowe się pojawią. Tutaj bardzo pomocny będzie doustny probiotyk S. salivarius M18.
 Choroby przyzębia mogą być bardzo bolesne. Mogą one prowadzić do zaniku kości wyrostka zębodołowego a tym samym być przyczyną kalectwa w przypadku utraty zębów i resorpcji kości żuchwy.
Choroby przyzębia mogą być bardzo bolesne. Mogą one prowadzić do zaniku kości wyrostka zębodołowego a tym samym być przyczyną kalectwa w przypadku utraty zębów i resorpcji kości żuchwy.
Nowe badania naukowe wykazują, że choroby przyzębia mogą mieć daleko idące konsekwencje dla zdrowia całego organizmu. Powodują one stany zapalne a także zakłócają szlaki sygnałowe w całym organizmie.
Choroby przyzębia mogą powodować zaburzenia prawidłowych funkcji mózgu, serca, płuc, nerek, wątroby i naczyń krwionośnych. Wszystkie te zaburzenia przyspieszają proces starzenia się i skracają życie.7-14
Dobrą wiadomością jest fakt, że redukcja nazębnej płytki bakteryjnej powoduje znaczną redukcję stanów zapalnych w całym organizmie. Oznacza to, że poprawa stanu zdrowia zębów i dziąseł jest niezbędna nie tylko dla zdrowia jamy ustnej, ale także dla zdrowia całego organizmu.
Wszechstronny probiotyczny system obrony jamy ustnej
 Odporny na choroby, prawidłowy mikrobiom jamy ustnej to szeroki wachlarz pożytecznych szczepów bakteryjnych pełniących ważne funkcje biologiczne. Mikrobiom dysbiotyczny to taki, w którym dominuje jeden lub kilka szkodliwych szczepów, tworząc tym samych środowisko sprzyjające tworzeniu się stanów zapalnych w obrębie jamy ustnej.
Odporny na choroby, prawidłowy mikrobiom jamy ustnej to szeroki wachlarz pożytecznych szczepów bakteryjnych pełniących ważne funkcje biologiczne. Mikrobiom dysbiotyczny to taki, w którym dominuje jeden lub kilka szkodliwych szczepów, tworząc tym samych środowisko sprzyjające tworzeniu się stanów zapalnych w obrębie jamy ustnej.
Według badań naukowych, dla przywrócenia prawidłowego mikrobiomu jamy ustnej a także dla uniknięcia chorób dziąseł, konieczne jest dodatkowe wsparcie kolonizacji oraz wzrostu pożytecznych szczepów bakteryjnych.22
Pożyteczne szczepy bakteryjne konkurują ze szkodliwymi szczepami zmniejszając ich populacje i umożliwiając kolonizację szerszej gamie korzystnie działających szczepów bakteryjnych.
S. salivarius M18 jest jednym z korzystnie działających szczepów bakteryjnych. Wypiera on niebezpieczne szczepy bakteryjne w jamie ustnej, powodujące lub/i nasilające choroby przyzębia. Wykazano, że S. salivarius M18 wpływa korzystnie na stan zdrowia dziąseł i chroni przed chorobami przyzębia.15,16
Przeprowadzono randomizowane, kontrolowane badanie w celu określenia wpływu szczepu S. salivarius M18 na niektóre z najważniejszych parametrów klinicznych zdrowia jamy ustnej i dziąseł.23 Badaniem objęto mężczyzn i kobiety w wieku 20–60 lat z umiarkowanym lub ciężkim zapaleniem dziąseł (wskaźnik stanu zapalnego dziąseł 2 lub 3) oraz umiarkowanym zapaleniem przyzębia (głębokość kieszonek dziąsłowych poniżej 6 mm).
Jedna połowa badanych nie była leczona, a druga połowa otrzymywała codziennie po szczotkowaniu zębów pastylki do ssania zawierające 200 milionów S. salivarius M18. Pacjenci przyjmowali pastylki do ssania przez 30 dni. Dla ustalenia, czy korzystny wpływ S. salivarius M18 utrzyma się także po zaprzestaniu stosowania pastylek zawierających ten szczep bakteryjny, naukowcy prowadzili obserwację przez kolejnych 30 dni.
Wyniki grupy otrzymującej S. salivarius M18 w porównaniu z grupą kontrolną - były korzystne dla wszystkich czterech pomiarów:23
- Średni wynik wskaźnika płytki nazębnej zmniejszył się o 44% w dniu 30 (ostatni dzień leczenia) oraz o 37% w dniu 60.
- Średni wynik wskaźnika stanu zdrowia dziąseł został zmniejszony o 42% w dniu 30 i o 35% w dniu 60.
- Zmodyfikowany wskaźnik krwawienia dziąseł został zmniejszony o 53% w dniu 30 i o 51% w dniu 60.
- Głębokość kieszonek dziąsłowych została zmniejszona o 20% w dniu 30 i o 22% w dniu 60.
Warto zauważyć, że najniższe wyniki dla każdego wskaźnika w grupie stosującej S. salivarius M18 wskazywały na powrót do prawie normalnych wartości - mniejszych niż 1 dla wskaźnika płytki nazębnej, wskaźnika stanu zdrowia dziąseł i zmodyfikowanego wskaźnika krwawienia dziąseł, oraz w przypadku głębokości kieszonek dziąsłowych do nieco ponad 3 mm. Wartości te pozostały jednak nieprawidłowe w grupie kontrolnej.23
Badanie to wykazało korzystny wpływ probiotycznego suplementu do ssania nie tylko na znaczną poprawę wszystkich czterech najważniejszych parametrów zdrowia przyzębia w czasie stosowania suplementu, ale także po zakończeniu suplementacji.
Wcześniejsze badania kliniczne przedstawiają dodatkowe dowody na to, że stosowanie S. salivarius M18 działa korzystnie dla zdrowia jamy ustnej.
 Dysbioza (brak równowagi mikrobiomu) jamy ustnej powoduje głęboką dysfunkcję układu odpornościowego w ochronie zębów i dziąseł. Dyzbioza ma bardzo negatywny wpływ na zdrowie jamy ustnej:
Dysbioza (brak równowagi mikrobiomu) jamy ustnej powoduje głęboką dysfunkcję układu odpornościowego w ochronie zębów i dziąseł. Dyzbioza ma bardzo negatywny wpływ na zdrowie jamy ustnej:
- Po pierwsze, dysbioza jamy ustnej i bakterie chorobotwórcze (np. P. gingivalis) są ściśle związane ze zwiększoną aktywnością cytokin zapalnych (cząsteczek sygnałowych), zwłaszcza IL-6.18
- Po drugie, dysbioza zmniejsza produkcję IL-12, cytokiny regulacyjnej, która wspomaga prawidłową odpowiedź na czynniki zapalne oraz prawidłowy proces gojenia. Upośledzona odpowiedź na czynniki zapalne sprzyja utrzymywaniu się stanu zapalnego i spowolnionego procesu gojenia. To z kolei sprzyja rozwojowi niekorzystnie działających szczepów bakteryjnych w jamie ustnej.18,30,31
Wraz z wiekiem, produkcja IL-12 ulega redukcji, co niestety osłabia odpowiedź organizmu na czynniki zapalne w obrębie jamy ustnej.32 Ta luka w układzie immunologicznym, umożliwia niekorzystnie działającym szczepom bakteryjnym, takim jak P. gingivalis nadmierny rozwój, powodując tym samym choroby przyzębia.30
Co gorsza, sam P. gingivalis dodatkowo osłabia odpowiedź organizmu na czynniki zapalne, zmniejszając poziom korzystnej IL-12 i zwiększając poziom prozapalnej IL-6.18-20,30. Umożliwia to zwiększony wzrost P. gingivalis a także innych niekorzystnie działających drobnoustrojów wywołujących infekcje i stany zapalne w jamie ustnej.33
Ponadto, kiedy poziomy IL-6 są wysokie, a jednocześnie poziomy IL-12 pozostają niskie, wówczas stany zapalne dziąseł nie ustępują. Prowadzi to do przewlekłego stanu zapalnego, który ostatecznie uszkadza kość szczękową i powoduje utratę zębów.10,18-20
P. gingivalis uwalnia fragmenty chemiczne, które tłumią działanie niektórych komórek odpornościowych i „ukrywają się” jako normalne, korzystne szczepy bakteryjne, jednocześnie atakując tkanki gospodarza i tłumiąc odpowiedź immunologiczną na inne gatunki niepożądanych bakterii.
Jak to działa
 S. salivarius M18 działa poprzez kilka mechanizmów, które pomagają stworzyć zdrowsze środowisko jamy ustnej. W przeciwieństwie do wielu preparatów probiotycznych, S. salivarius M18 może specyficznie kolonizować jamę ustną. Skutkuje to stabilnie rozwijającą się kolonią S. salivarius M18, nawet po zakończeniu suplementacji.16
S. salivarius M18 działa poprzez kilka mechanizmów, które pomagają stworzyć zdrowsze środowisko jamy ustnej. W przeciwieństwie do wielu preparatów probiotycznych, S. salivarius M18 może specyficznie kolonizować jamę ustną. Skutkuje to stabilnie rozwijającą się kolonią S. salivarius M18, nawet po zakończeniu suplementacji.16
Wykazano również, że S. salivarius M18 skutecznie wypiera bakterie takie jak Streptococcus mutans, mogące powodować ubytki zębów.15
S. salivarius M18 wytwarza bakteriocynę hamującą wzrost niepożądanych bakterii.
Bakteriocyna działa podobnie do antybiotyków, ale są całkowicie naturalna i działa tylko na poziomie lokalnym między różnymi szczepami bakteryjnymi.24
Bakteriocyny wytwarzane przez S. salivarius M18 należą do klasy zwanej lantibiotics, wykorzystującej mechanizm działania polegający na uszkadzaniu błony komórkowej organizmu docelowego, prowadząc do jego zniszczenia 25, 26 W taki właśnie sposób S. salivarius M18 hamuje wzrost kilku dobrze znanych bakterii odpowiedzialnych za choroby zębów i dziąseł, w tym S. mutans, S. sobrinus i Actinomyces naeslundii.15,24,27,28
Oprócz zwalczania organizmów chorobotwórczych S. salivarius M18 wytwarza także enzymy rozkładające płytkę nazębną - główną przyczynę próchnicy zębów i chorób dziąseł. S. salivarius M18 pomaga również utrzymać neutralne pH w jamie ustnej, które wspomaga rozwój korzystnie działających bakterii. Zrównoważony mikrobiom jamy ustnej oznacza mniejsze ryzyko pojawienia się chorób w obrębie jamy ustnej.15
S. salivarius M18 zmniejsza ponadto obecność prozapalnej cytokiny IL-6 powodującej choroby przyzębia.15 W połączeniu ze szczepem L. plantarum L-137 - chroni przed przewlekłymi stanami zapalnymi przyzębia.
 Badanie stanu zdrowia jamy ustnej u dentysty nie należy do przyjemności, pozwala jednak na dokładną ocenę stan zdrowia zębów i dziąseł.
Badanie stanu zdrowia jamy ustnej u dentysty nie należy do przyjemności, pozwala jednak na dokładną ocenę stan zdrowia zębów i dziąseł.
Podczas takiego badania, stomatolog zwraca uwagę na kilka wskaźników świadczących o stanie zdrowia jamy ustnej. Umożliwia to zaplanowanie najlepszej metody leczenia.
W badaniach omawianych w tym artykule wykorzystano następujące wskaźniki:
- Wskaźnik płytki nazębnej: ocena od zera do 3, przy czym zero oznacza brak płytki nazębnej, a 3 oznacza obfitość płytki nazębnej, rozciągającej się poniżej linii dziąseł na zębach.34
- Wskaźnik stanu zdrowia dziąseł: od zera do 3, przy czym zero oznacza zdrowe dziąsła, a 3 oznacza ciężki stan zapalny dziąseł z obrzękiem, owrzodzeniem i tendencją do spontanicznego krwawienia.34
- Zmodyfikowany wskaźnik krwawienia z kieszonki dziąsłowej: od zera do 3, przy czym zero oznacza brak krwawienia przy delikatnym sondowaniu zębów, a 3 oznacza krwawienie, zmianę koloru i obrzęk dziąseł.35
- Głębokość kieszonek dziąsłowych: za pomocą skalibrowanej sondy oznaczonej w milimetrach dentysta lub higienistka mierzy głębokość kieszonki pomiędzy korzeniem zęba a dziąsłem. Zasadniczo im głębsza kieszonka, tym gorszy stan dziąseł. Kieszonki dziąsłowe o głębokości 3 mm lub mniejszej uważa się za prawidłowe, zdrowe. Kieszonki dziąsłowe o głębokości powyżej niż 4 mm wskazują natomiast na stany zapalne przyzębia.21,36
Podsumowanie
Choroby dziąseł są powszechne, zwłaszcza po 30-tym roku życia.
Szczotkowanie i nitkowanie zębów są ważne, ale nie są wystarczające dla przywrócenia równowagi mikrobiomu jamy ustnej.
Ostatnie postępy w zrozumieniu korzyści wynikających z zastosowania pożytecznych bakterii (probiotyków) ujawniają dwutorowe podejście w przywracaniu równowagi mikrobiomu i uzyskaniu prawidłowych funkcji odpornościowych jamy ustnej.
L. plantarum L-137 zawiera pożyteczne bakterie L. plantarum, które poprawiają funkcję odpornościową jamy ustnej, zmniejszają stan zapalny i wspomagają proces gojenia.
S. salivarius M18 jest sprawdzonym doustnym probiotykiem zdolnym do kolonizacji jamy ustnej, gdzie niszczy niepożądane, szkodliwe bakterie.
Te dwa probiotyki, przyjmowane codziennie w formie pastylki do ssania, działając synergistycznie wspomagają nie tylko zdrowie jamy ustnej ale także zdrowie całego organizmu.
Materiał wykorzystany za zgodą Life Extension. Wszelkie prawa zastrzeżone.
-
Available at: http://www.cdc.gov/OralHealth/children_adults/adults.htm. Accessed October 25, 2016.
-
Available at: http://www.cdc.gov/oralhealth/periodontal_disease/. Accessed December 8, 2016.
-
Sampaio-Maia B, Caldas IM, Pereira ML, et al. The Oral Microbiome in Health and Its Implication in Oral and Systemic Diseases. Adv Appl Microbiol. 2016;97:171-210.
-
Saffi MA, Furtado MV, Polanczyk CA, et al. Relationship between vascular endothelium and periodontal disease in atherosclerotic lesions: Review article. World J Cardiol. 2015;7(1):26-30.
-
Yao QW, Zhou DS, Peng HJ, et al. Association of periodontal disease with oral cancer: a meta-analysis. Tumour Biol. 2014;35(7):7073-7.
-
Watts A, Crimmins EM, Gatz M. Inflammation as a potential mediator for the association between periodontal disease and Alzheimer’s disease. Neuropsychiatr Dis Treat. 2008;4(5):865-76.
-
Kamer AR, Pirraglia E, Tsui W, et al. Periodontal disease associates with higher brain amyloid load in normal elderly. Neurobiol Aging. 2015;36(2):627-33.
-
Prasanna SJ. Causal relationship between periodontitis and chronic obstructive pulmonary disease. J Indian Soc Periodontol. 2011;15(4):359-65.
-
Fisher MA, Taylor GW, West BT, et al. Bidirectional relationship between chronic kidney and periodontal disease: a study using structural equation modeling. Kidney Int. 2011;79(3):347-55.
-
Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 2015;15(1):30-44.
-
Humphrey LL, Fu R, Buckley DI, et al. Periodontal disease and coronary heart disease incidence: a systematic review and meta-analysis. J Gen Intern Med. 2008;23(12):2079-86.
-
Liu Z, Zhang W, Zhang J, et al. Oral hygiene, periodontal health and chronic obstructive pulmonary disease exacerbations. J Clin Periodontol. 2012;39(1):45-52.
-
Scannapieco FA, Bush RB, Paju S. Associations between periodontal disease and risk for nosocomial bacterial pneumonia and chronic obstructive pulmonary disease. A systematic review. Ann Periodontol. 2003;8(1):54-69.
-
Kshirsagar AV, Moss KL, Elter JR, et al. Periodontal disease is associated with renal insufficiency in the Atherosclerosis Risk In Communities (ARIC) study. Am J Kidney Dis. 2005;45(4):650-7.
-
Burton JP, Drummond BK, Chilcott CN, et al. Influence of the probiotic Streptococcus salivarius strain M18 on indices of dental health in children: a randomized double-blind, placebo-controlled trial. J Med Microbiol. 2013;62(Pt 6):875-84.
-
Burton JP, Wescombe PA, Macklaim JM, et al. Persistence of the oral probiotic Streptococcus salivarius M18 is dose dependent and megaplasmid transfer can augment their bacteriocin production and adhesion characteristics. PLoS One. 2013;8(6):e65991.
-
Iwasaki K, Maeda K, Hidaka K, et al. Daily Intake of Heat-killed Lactobacillus plantarum L-137 Decreases the Probing Depth in Patients Undergoing Supportive Periodontal Therapy. Oral Health Prev Dent. 2016;14(3):207-14.
-
Liang S, Krauss JL, Domon H, et al. The C5a receptor impairs IL-12-dependent clearance of Porphyromonas gingivalis and is required for induction of periodontal bone loss. J Immunol. 2011;186(2):869-77.
-
Johnson RB, Serio FG. Interleukin-18 concentrations and the pathogenesis of periodontal disease. J Periodontol. 2005;76(5):785-90.
-
Gemmell E, Seymour GJ. Immunoregulatory control of Th1/Th2 cytokine profiles in periodontal disease. Periodontol 2000. 2004;35:21-41.
-
Available at: http://www.merckmanuals.com/professional/dental-disorders/periodontal-disorders/periodontitis. Accessed February 1, 2017.
-
Bonifait L, Chandad F, Grenier D. Probiotics for oral health: myth or reality? J Can Dent Assoc. 2009;75(8):585-90.
-
Scariya L, Nagarathna DV, Varghese M. Probiotics in Periodontal Therapy. Int J Pharm Bio. 2015 Jan;6(1):242-50.
-
Wescombe PA, Upton M, Renault P, et al. Salivaricin 9, a new lantibiotic produced by Streptococcus salivarius. Microbiology. 2011;157(Pt 5):1290-9.
-
Bierbaum G, Sahl HG. Lantibiotics: mode of action, biosynthesis and bioengineering. Curr Pharm Biotechnol. 2009;10(1):2-18.
-
Islam MR, Nagao J, Zendo T, et al. Antimicrobial mechanism of lantibiotics. Biochem Soc Trans. 2012;40(6):1528-33.
-
Wescombe PA, Burton JP, Cadieux PA, et al. Megaplasmids encode differing combinations of lantibiotics in Streptococcus salivarius. Antonie Van Leeuwenhoek. 2006;90(3):269-80.
-
Wescombe PA, Upton M, Dierksen KP, et al. Production of the lantibiotic salivaricin A and its variants by oral streptococci and use of a specific induction assay to detect their presence in human saliva. Appl Environ Microbiol. 2006;72(2):1459-66.
-
Fasula K, Evans CA, Boyd L, et al. Randomized trial of Plaque identifying Toothpaste: Dental Plaque and Inflammation. Am J Med. 2016.
-
Hajishengallis G, Shakhatreh MA, Wang M, et al. Complement receptor 3 blockade promotes IL-12-mediated clearance of Porphyromonas gingivalis and negates its virulence in vivo. J Immunol. 2007;179(4):2359-67.
-
Li L, Hsu HC, Stockard CR, et al. IL-12 inhibits thymic involution by enhancing IL-7- and IL-2-induced thymocyte proliferation. J Immunol. 2004;172(5):2909-16.
-
Banerjee C, Ulloor J, Dillon EL, et al. Identification of serum biomarkers for aging and anabolic response. Immun Ageing. 2011;8(1):5.
-
Costalonga M, Herzberg MC. The oral microbiome and the immunobiology of periodontal disease and caries. Immunol Lett. 2014;162(2 Pt A):22-38.
-
Loe H. The Gingival Index, the Plaque Index and the Retention Index Systems. J Periodontol. 1967;38(6):Suppl:610-6.
-
Wei SH, Lang KP. Periodontal epidemiological indices for children and adolescents: I. Gingival and periodontal health assessments. Pediatr Dent. 1981;3(4):353-60.
-
Available at: http://www.draxelrad.com/what-do-the-probing-measurements-mean/. Accessed 6 January, 2017


